Bioactividad y propiedades fisicoquímicas de tres cementos a base de silicato de calcio: un estudio in vitro
May 28 de 2020 0
Resumen
Objetivo . Este estudio evaluó la bioactividad y las propiedades fisicoquímicas de tres materiales endodónticos comerciales a base de silicato de calcio (MTA, masilla EndoSequence Root Repair Material y Biodentine ™). Material y métodos. Se sometieron secciones horizontales de 3 mm de espesor de 18 conductos radiculares de dientes humanos a preparación biomecánica con instrumentos rotativos grandes WaveOne Gold. Las doce muestras se llenaron con tres materiales probados (MM-MTA, masilla de material de reparación de raíz EndoSequence y Biodentine ™) y se sumergieron en solución salina tamponada con fosfato durante 7 y 30 días. Después de este período de tiempo, cada muestra de cada material se procesó para observación morfológica, precipitados superficiales y dentina interfacial usando SEM. Además, la morfología de la superficie de los materiales del conjunto, sin remojo en solución tamponada con fosfato después de un día y después de 28 días almacenados en solución salina tamponada con fosfato, se evaluó mediante SEM; además, El pH del agua de remojo y la cantidad de iones de calcio liberados de los materiales de prueba se midieron utilizando una prueba de espectroscopía de emisión óptica de plasma acoplada inductivamente. Los datos obtenidos se analizaron mediante un análisis de varianza unidireccional y la prueba de diferencia significativa honesta de Tukey con un nivel de significación del 5%.Resultado . Se observó la formación de precipitados en las superficies de todos los materiales a 1 semana y aumentó sustancialmente con el tiempo. Se encontraron capas interfaciales en algunas áreas de la interfaz dentina-cemento después de una semana de inmersión. Todos los materiales analizados mostraron pH alcalino y capacidad para liberar iones de calcio; sin embargo, las concentraciones de iones de calcio liberados fueron significativamente mayores en Biodentina y masilla ESRRM que MM-MTA () La masilla ESRRM mantuvo un pH de alrededor de 11 después de 28 días. Conclusión . En comparación con MM-MTA, la masilla Biodentine y ESRRM mostró una liberación significativamente mayor de iones calcio. Sin embargo, la exposición de tres cementos probados a una solución tamponada con fosfato resultó en la precipitación de estructuras cristalinas de apatita sobre cemento y dentina que aumentaron con el tiempo. Esto sugiere que los materiales probados son bioactivos.
1. Introducción
Los cementos a base de silicato de calcio utilizados para diferentes situaciones clínicas de endodoncia, como el recubrimiento pulpar, la apexificación, los rellenos del extremo de la raíz y la perforación, deben poseer biocompatibilidad, radiopacidad, actividad antibacteriana, fácil manipulación, buena capacidad de sellado y bioactividad [ 1 ].
La bioactividad de un biomaterial juega un papel clave en la regeneración y curación de tejidos [ 2 ]. El rendimiento de los materiales de silicato de calcio es atribuible en gran medida a su bioactividad, es decir, su capacidad para liberar iones de calcio (Ca 2+ ) y producir precipitados cristalinos de tipo apatito cuando entran en contacto con fluidos fisiológicos que contienen fosfato [ 3 - 8 ]. Los precipitados se producen como resultado de la disolución del hidróxido de calcio formado a través de reacciones de hidratación; El aumento resultante en la alcalinidad y la concentración de Ca 2+ mejora la sobresaturación del fluido que contiene fosfato con respecto a la apatita y, por lo tanto, promueve la precipitación [ 9 ].
Los cementos de silicato de calcio, como el cemento Portland o el agregado de trióxido mineral (MTA), actualmente exhiben un potencial sustancial para su uso como biomateriales y se han utilizado en una variedad de aplicaciones endodóncicas [ 10 , 11 ]. MTA es un material bioactivo que presenta una excelente capacidad de formación de apatita [ 12 ] y exhibe una excelente capacidad de sellado, un pH alto, radiopacidad, biocompatibilidad y una capacidad para estimular la expresión de la proteína de la matriz de dentina [ 13 - 16 ]. Sin embargo, dado que la MTA todavía tiene algunos inconvenientes, recientemente se han desarrollado varios materiales nuevos a base de silicato de calcio [ 12 , 17] destinado a mejorar algunos de estos inconvenientes, como el potencial de decoloración, la presencia de elementos tóxicos en la composición del material, las características de manipulación difíciles, el tiempo de fraguado prolongado, el alto costo del material, la ausencia de un solvente conocido para este material y la dificultad de su eliminación después de curar
MicroMega MTA (MM-MTA; MicroMega, Besançon, Francia), otra formulación de MTA, se desarrolló en 2011 para superar los inconvenientes de los productos originales de MTA. Es un cemento inyectable osteoconductor, osteoinductivo y biocompatible a base de silicato tricálcico y también contiene carbonato de calcio, que ayuda a reducir el tiempo de fraguado [ 18 ]. La integración biológica de MM-MTA se debe a los iones de calcio, que forman hidroxiapatita en contacto con los iones de fosfato presentes en el cuerpo [ 19 ].
Biodentine (BD) (Septodont, Saint Maur des Fosses, Francia) se desarrolló en 2009 como un nuevo cemento a base de silicato tricálcico [ 20 ]. Fue descrito como un sustituto bioactivo de la dentina debido a que tiene propiedades mecánicas similares a la dentina. Además, se puede utilizar con indicaciones similares a MTA [ 21 , 22 ]. Al igual que MTA, BD muestra la formación de apatita después de la inmersión en solución de fosfato que es indicativo de su bioactividad.
Se desarrolló un material alternativo, la masilla EndoSequence Root Repair Materials (masilla ESRRM), como material inyectable premezclado formulado con tecnología biocerámica. Ha sido lanzado por Brasseler USA (Savannah, GA) para ser utilizado como un reemplazo clínico para la MTA. La masilla ESRRM tiene las ventajas de un fraguado más rápido y propiedades de manejo superiores [ 23 ]. Esta masilla posee una estabilidad mejorada del color y características de manejo mientras exhibe propiedades físicas y químicas comparables con MTA. La propiedad más importante es que este material puede liberar iones de calcio y fosfato, que son esenciales para la deposición de hidroxiapatita [ 24 ].
Por lo tanto, el objetivo de este estudio fue evaluar la textura de la superficie y la capacidad de formación de apatita, la liberación de Ca 2+ y el pH de MM-MTA, masilla ESRRM y BD en contacto con fluidos fisiológicos que contienen fosfato durante diferentes períodos de tiempo.
2. Material y método
Se usaron tres materiales basados en silicato de calcio, MM-MTA (Lote no. 71708614), Masilla de material de reparación de raíz EndoSequence (Lote no. B19585) y Biodentina (Lote no. 5024200 U0). La composición de los materiales de prueba se muestra en la Tabla 1 . El protocolo de investigación fue aprobado por el Comité Ético de la Universidad de Sulaimani (número de aprobación 9, 6.2.2017). La cápsula MicroMega MM-MTA (MicroMega, Besançon, Francia) y la masilla EndoSequence Root Repair Material (BC Fast Set Putty, lista para usar; Brasseler USA-Savannah, GA) se usaron directamente, mientras que Biodentine (Septodont, Saint Maur de Fosses, Francia) se preparó de acuerdo con las recomendaciones del fabricante y se insertó mediante un transportador de amalgama (Shanghai, China) y se condensó con un condensador de cenizas de pequeño tamaño (Shanghai, China).
2.1. Observación de la interfaz cemento-dentina
Se utilizaron un total de dieciocho dientes humanos de raíz única, sin caries, con un ápice cerrado, extraídos por diferentes razones. Las coronas de cada diente se seccionaron en la unión cemento-esmalte usando un disco de diamante refrigerado por agua a baja velocidad. La longitud de trabajo para la instrumentación del conducto radicular se verificó por el método directo, y se determinó que la longitud era 1 mm más corta que la longitud real de la raíz. Los conductos radiculares fueron instrumentados por WaveOne Gold grande (Dentsply Tulsa Dental, Tulsa, OK, EE. UU.) Bajo riego abundante con hipoclorito de sodio al 3% (Neo Cleaner, Neo Dental, Tokio, Japón). Luego, los canales se irrigaron con ácido etilendiaminotetraacético al 17% (EDTA; Ultradent, South Jordan), seguido de hipoclorito de sodio al 3% durante 1 minuto cada uno, se lavaron inmediatamente con agua purificada y se secaron con puntas de papel absorbente (VDW, Munich, Alemania). mm secciones gruesas de raíz. Las secciones de raíz se llenaron aleatoriamente con los 3 materiales probados. Se eliminó cuidadosamente cualquier material de acceso en la superficie de todas las muestras, y las muestras se envolvieron en gasas empapadas en solución salina tamponada con fosfato (PBS) durante 1 hora. Después de eso, cada rebanada llena de raíz se sumergió individualmente en 2 ml de solución de PBS () dentro de tubos de plástico Eppendorf estériles (Eppendorf-Elkay, Shrewsbury, MA, EE. UU.) e incubados a 37 ° C. El PBS fue reemplazado cada 7 días [ 7 , 25 ]. Después de 7 y 30 días, las secciones raíz (, en cada período) para cada material se secaron a 37 ° C durante 24 h. Luego, las muestras se montaron en trozos metálicos, se pulverizaron con oro y se examinaron bajo un microscopio electrónico de barrido (Cesio, versión 6.1.10, ID 634258760) (CS3200 Tungsteno) a un voltaje de aceleración de 40 kV. Se tomaron fotomicrografías SEM a varios aumentos (15-3,000x) para identificar la formación de precipitados de ultraestructura en la superficie de los cementos y / o en las interfaces dentina-cemento.
2.2. Análisis de morfología de superficie
La morfología topográfica y la organización estructural de la superficie de los tres cementos hidratados se probaron experimentalmente en seis muestras. Cada material se colocó en dos tubos de plástico (10 mm de longitud, 2 mm de diámetro interno y 3,8 mm de diámetro externo con ambos extremos abiertos) y se dejó fraguar. Un tubo se dejó seco durante 1 día y el otro se empapó en PBS durante 28 días. En el momento del examen, las muestras húmedas se secaron en un desecador de vacío. Se retiró cada tubo y el cemento extraído se diseccionó en dos planos, lo que dio como resultado cuatro piezas que representaban las superficies exterior e interior del material fraguado. Luego, fueron recubiertos de oro para el examen SEM. Se tomaron imágenes retrodispersadas de la superficie del cemento con diferentes aumentos por debajo de 40 kV.
La aparición de una masa o nódulo blanco en la superficie del material o dentro de la raíz después de la exposición a PBS indicó la formación de precipitado y se atribuyó a la capacidad de sellado de los cementos de silicato de calcio. Además, la presencia de una aguja, o cúbico, o un cristal circular esférico y en forma de listón observado por SEM después del proceso de hidratación de MM-MTA, masilla ESRRM y BD después de la inmersión en PBS atribuido a la capacidad de formación de apatita y a las propiedades de bioactividad. [ 6 , 12 ].
2.3. Medición de pH y liberación de iones de calcio
Un total de 30 tubos de plástico (10 mm de longitud, 2 mm de diámetro interno, ambos extremos abiertos) se dividieron en dos grupos: uno para medir el pH y otro para medir la cantidad de liberación de Ca2 + . Cada grupo se subdividió en 3 subgrupos según el material insertado (5 tubos en cada uno). Los tubos se pesaron para estandarizar la cantidad de cemento (± 0,002 g) y se sumergieron inmediatamente en 40 ml de agua desionizada (pH 6,9 y sin iones de calcio), se sellaron con Parafilm y se mantuvieron en una incubadora (37 ° C) durante todo el proceso. el periodo de estudio Todo el equipo de laboratorio se trató previamente con ácido nítrico (65%) y se lavó con agua desionizada.
El medidor de pH (modelo: PTR 79, ZAG CHEMIE Company, China) se estandarizó inicialmente con soluciones tamponadas (pH 7) y se recalibró antes de analizar cada nueva muestra a temperatura ambiente.. Para cada muestra, el pH se midió dos veces (calculando el valor medio) después de retirar la muestra y agitar el recipiente durante 5 segundos. El electrodo de pH se sumergió y mantuvo durante aproximadamente tres minutos en cada recipiente mientras se agitaba para permitir un contacto uniforme con la punta del electrodo y evitar la formación de burbujas de aire o tocar la base del recipiente para evitar resultados falsos. Luego, el electrodo se enjuagó a fondo con agua destilada, se secó con toallitas y se volvió a sumergir en la misma muestra o en una nueva muestra. La medición se realizó en períodos de 3 horas, 24 horas, 7 días, 15 días y 30 días. El pH medio se trazó contra el tiempo.
La medición de Ca 2+ liberado en agua de remojo se realizó después de la extracción de muestras del contenedor después de 1, 2, 7 y 28 días mediante el uso de una prueba de espectroscopía de emisión óptica de plasma acoplada inductivamente (Optima 2100 DV Perkin Elmer). Se utilizó HNO3 (5%) con 5, 10 y 15 ppm de Ca como una concentración en serie para la calibración antes de leer el calcio liberado. La cantidad de Ca 2+ se midió en ppm. La liberación acumulada de calcio se calculó por separado para cada una de las cinco muestras de materiales analizados sumando las cantidades liberadas en los cuatro puntos finales diferentes.
2.4. Análisis estadístico
Los datos distribuidos normalmente se analizaron mediante una prueba paramétrica utilizando el software estadístico SPSS versión 25 para Windows (SPSS, Chicago, Il, EE. UU.). El análisis de varianza unidireccional (ANOVA) se utilizó para realizar el análisis estadístico, seguido de la prueba de diferencia significativa honesta de Tukey con un nivel de significancia del 5%.
3. Resultado
3.1. Análisis SEM
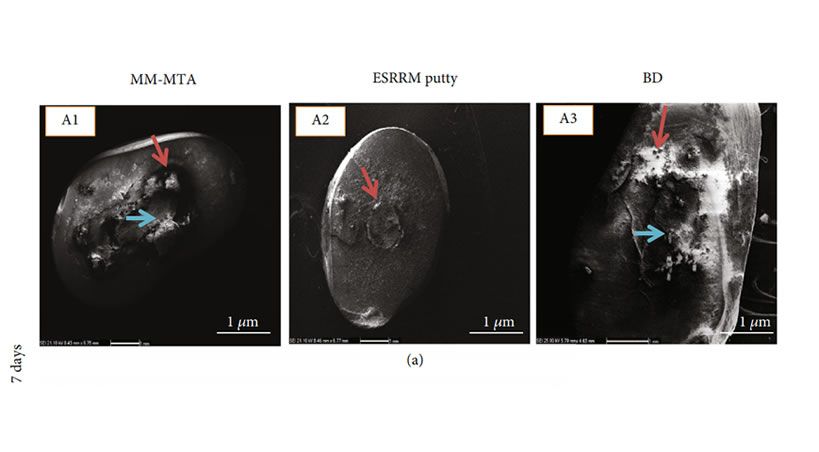
El análisis por microscopía electrónica de barrido reveló una formación de cristales de apatita sobre los cementos a lo largo de la interfaz (flechas de cabeza azul) y dentro de la dentina interfacial (flechas de cabeza roja) en todos los grupos. Hubo formación limitada de precipitados en las superficies de los tres cementos después de 1 semana de inmersión en PBS (Figura 1 (a)). Después de 28 días, la topografía de los cementos cambió drásticamente y sus superficies quedaron cubiertas por una cantidad considerablemente más considerable de precipitados y formaciones de cristal de apatita (Figura 1 (c)). Después de 28 días, el análisis SEM de precipitados reveló que la morfología de las partículas es más uniforme y uniforme que después de 1 semana para muestras de MM-MTA, masilla ESRRM y Biodentine.
La evaluación por microscopía electrónica de barrido de Biodentine después de 1 semana de inmersión reveló más precipitados esféricos tanto en la superficie del material como en la interfaz dentina-material (Figura 1 (A3 y B3)) en comparación con la masilla MM-MTA y ESRRM.
Esta zona interfacial estaba compuesta de un área desprovista de partículas más grandes pero con partículas más pequeñas intercaladas en la región interfacial. Esto fue más evidente en MM-MTA, masilla ESRRM y Biodentine después de 28 días de inmersión. La penetración del túbulo dentinal fue menor en la masilla ESRRM en comparación con los otros cementos después de 28 días (Figura 1 (d)).
En la Figura 2 se muestran superficies representativas de la mezcla hidratada de MM-MTA, masilla ESRRM y Biodentina después de un día y antes de remojarlas en PBS, así como después de almacenarlas en PBS durante 28 días . La masilla ESRRM hidratada exhibió una estructura de cristal hexagonal pequeña y más desarrollada en comparación con MM-MTA y Biodentina mixtas (Figuras 2 (d) –2 (f)). Sin embargo, Biodentine almacenado en PBS exhibió una superficie relativamente más lisa en comparación con la masilla MM-MTA y ESRRM (Figuras 2(h) y 2 (i)). Se observó una estructura densa y homogénea en los tres cementos fijados después de 28 días en PBS, con porosidades más pequeñas en la masilla MM-MTA y ESRRM en comparación con el grupo Biodentine (flechas de cabeza roja), y después de 28 días de almacenamiento en PBS, el exterior la superficie era amorfa y regular, con muchos depósitos visibles compuestos de agregados de nanoesferulitas de apatita en geometría de corte vertical (Figuras 2 (b), 2 (e) y 2 (h)). Se detectaron cristales hexagonales y cúbicos difusos más grandes (con forma de aguja) (flechas de cabeza azul) en todas las superficies de cemento después de 28 días de inmersión en PBS en corte horizontal (Figuras 2 (c), 2 (f) y 2 (i)).
3.2. Medición de pH y liberación de iones de calcio
Todos los materiales indujeron la alcalinización del agua de remojo que disminuyó con el tiempo pero aún estaba presente a los 28 días (Figura 3 ). Alcalizaron el agua de remojo a pH 11.7 en tiempos cortos (después de 24 horas), luego disminuyeron a un pH de> 9 después de 28 días, con un material (masilla ESRRM) manteniendo un valor de pH de alrededor de 11.
4. Discusión
Se utilizó una combinación de microscopía electrónica de barrido, liberación de iones de calcio y análisis de pH para caracterizar y evaluar la bioactividad y las propiedades fisicoquímicas de tres cementos diferentes a base de silicato de calcio. Este estudio demostró claramente que MM-MTA, la masilla EndoSequence Root Repair Material y Biodentine produjeron cristales de apatita que aumentaron drásticamente con el tiempo después de la inmersión en una solución que contiene fosfato, liberaron iones de Ca y poseían una alta alcalinidad, todo lo cual indica su bioactividad.
[ 26 ] ha abordado la superposición de los picos y la presencia de múltiples compuestos dentro de los materiales de identificación de fase y caracterización mediante análisis dispersivo de energía de rayos X. Por lo tanto, la microscopía electrónica de barrido y una prueba de espectroscopía de emisión óptica-plasma acoplada inductivamente se usaron en el presente estudio para permitir la observación de la microestructura del material y la visualización de la superficie y para medir la liberación de iones de calcio de cada material probado durante diferentes períodos de tiempo.
Ningún estudio previo evaluó el efecto de diferentes geometrías de corte (corte vertical y horizontal) de los cementos fraguados hidratados antes y después de la inmersión en PBS sobre la capacidad de formación de apatito, la cristalografía y la evaluación de la porosidad de la superficie utilizando SEM. Además, este estudio proporciona una nueva línea para la evaluación de la morfología de la superficie y la bioactividad de tres cementos a base de silicato de calcio con diferentes tipos de mezcla: premezclados y cargados en una jeringa (listos para usar) (masilla ESRRM), predosificados y suministrados en cápsula (MM-MTA), y mezcla de polvo y líquido de dos componentes (Biodentine) en un estudio con dos puntos de tiempo diferentes (en una semana y un mes).
En el presente estudio, PBS se usó como un fluido de tejido simulado que contiene fosfato con el fin de imitar condiciones normales in vivo en estudios de laboratorio [ 27 ]. La alta cantidad de fosfato en PBS representa la reposición continua de iones de fosfato de los fluidos tisulares, y en ausencia de calcio, la liberación de iones de calcio de los cementos se convierte en el parámetro limitante en la reacción de precipitación y marca la bioactividad del cemento experimental [ 13 , 28 ].
En este estudio, se utilizó una dentina de raíz humana para evaluar lúmenes de canal estándar que contienen tres cementos a base de silicato de calcio probados empapados en PBS durante 7 y 28 días, un método recomendado para la evaluación de la bioactividad del tejido duro y para obtener resultados clínicamente más relevantes [ 9 ]
Los tres materiales produjeron precipitados superficiales y formación de cristal de apatita después de la incubación en solución tamponada con fosfato, así como en la interfaz material-dentina para tres materiales; Se detectó la formación de una capa de apatita en la superficie de Biodentine y ProRoot MTA, así como en la interfaz material-dentina para ambos materiales. Esto es consistente con los hallazgos de una serie de estudios [ 8 , 29 ]. Aunque ningún estudio ha demostrado previamente la bioactividad de MM-MTA en la dentina de raíz humana, Khalil et al. [ 30 ] observó la mineralogía de MM-MTA durante su investigación de las propiedades físicas y químicas del material.
Las diferencias morfológicas en los cristales pueden representar, al menos en parte, la transformación de la fase de fosfato de calcio amorfo metaestable en una fase de apatita [ 28 ]. En este estudio, se observaron estructuras cristalinas de apatita que se hicieron más grandes con un mayor tiempo de inmersión, lo que confirma una tendencia observada en estudios anteriores [ 31 , 32 ]. Se ha encontrado que inmediatamente después de la hidratación del silicato tricálcico y / o dicálcico, los iones Ca y OH se liberan en el entorno circundante, lo que resulta en la formación de un precipitado de hidróxido de calcio (portlandita) y gel de silicato de calcio (CSH), y Con el aumento del tiempo, se produce una mayor precipitación como resultado de la presencia de iones de fósforo incluidos en los medios que contienen fosfato.
El crecimiento de una capa de apatita en cementos a base de silicato de calcio en soluciones que contienen fosfato es un entorno ideal para la diferenciación y colonización de células madre y osteoblastos para apoyar la formación de hueso nuevo. La apatita junto con las señales epigenéticas correlacionadas con la liberación de iones bien pueden explicar los excelentes resultados clínicos [ 33 ]. Además, la capacidad de formación de apatita puede proporcionar la ventaja clínica de un sellado mejorado mediante la deposición con el tiempo de fosfatos de calcio en la interfaz y dentro de los túbulos dentinarios del conducto radicular [ 34 ].
Otro hallazgo importante en este estudio se relacionó con la zona interfacial en MM-MTA, la masilla ESRRM y Biodentine con la interfaz de dentina después de 28 días de inmersión en PBS. Este hallazgo también es comparable a los hallazgos anteriores [ 8 , 29 , 35 ]. Los precipitados interfaciales se han descrito como apatita carbonatada con deficiencia de hidroxiapatita o calcio (es decir, fosfato de calcio amorfo (ACP)). La apatita carbonatada también se conoce como apatita biológica y representa la fase mineral del tejido duro (hueso, dentina y cemento) [ 36 ]. Los mecanismos involucrados en la formación de la capa interfacial incluyen la liberación de Ca 2+iones en el ambiente que contiene fosfato, durante y después del fraguado, y la formación de precipitado ACP que posteriormente se transforma en cristales de apatita [ 3 , 5 ]. Por lo tanto, la bioactividad del cemento de silicato de calcio se puede atribuir a su capacidad para formar apatita carbonatada, que es importante para la formación y mantenimiento de la interfaz biomaterial del tejido óseo. Estas observaciones, la formación de apatita y la capacidad de liberar iones de calcio y alta alcalinidad, se confirmaron en la superficie de los tres cementos probados y pueden explicar su potencial para estimular la reparación y promover la deposición del tejido duro, lo que indica su bioactividad.
La capacidad de liberar Ca +2 y OH− puede ser importante si consideramos las propiedades biointeractivas de estos iones. Sin embargo, el aumento del pH y la alta concentración de iones Ca 2+ [ 37 ] mejoran la sobresaturación de la solución con respecto a la apatita y promueven la precipitación de la capa de revestimiento de apatita carbonatada en la superficie del cemento.
Según el fabricante, estos cementos producen un pH alto, casi (12.5), pero el presente estudio encontró que el valor máximo de pH fue de 11.7 después de 24 horas. El pH alcalino induce un efecto antibacteriano y favorece la precipitación de apatita [ 38 ]. Se demostró que estos materiales alcalinizan fuertemente el medio de remojo en las primeras tres horas (hasta 10), alcanzando un nivel máximo después de 24 horas, con valores que luego disminuyen de 48 horas. A los 28 días, todos los materiales mostraron una, con un material (masilla ESRRM) manteniendo un valor de pH de alrededor de 11. Estos valores sugieren que estos materiales pueden preservar sus propiedades a largo plazo, brindando soporte a los procesos de curación perirradiculares.
Todas las soluciones de almacenamiento exhibieron un pH alcalinizante en todos los períodos de tiempo. BD exhibió un pH alto en comparación con MM-MTA, excepto al final del intervalo, con MM-MTA manteniendo una mejor alcalinidad que BD a los 28 días, y esto concuerda con estudios previos [ 30 , 39 ].
La actividad alcalinizante de la masilla ESRRM, que muestra un después de 1 día de inmersión, también respalda un hallazgo previo de Candeiro et al. [ 40 ] Además, la masilla ESRRM mostró una mayor actividad alcalinizante a largo plazo: el valor medio del pH en la evaluación de 28 días fue 11, lo que es consistente con otro estudio realizado por Zamparini et al. [ 41 ] Por otro lado, un estudio realizado por Lee et al. [ 42 ] encontraron un pH más bajo de la masilla ESRRM a las 24 horas, con el nivel máximo alcanzado a los 7 días y sin mantenimiento de un pH alto a los 14 días.
El ion calcio es el elemento principal que se filtra de los cementos basados en silicato de calcio e interactúa con el ambiente externo para formar precipitados cristalinos [ 4 , 28 ]. La liberación de calcio durante el proceso de hidratación es un buen indicador de la formación de hidratos de silicato de calcio debido a su estructura amorfa [ 43 ].
En el presente estudio, las cantidades de iones de calcio liberados de la masilla ESRRM y BD fueron significativamente mayores que para MM-MTA durante diferentes períodos de tiempo usando la espectroscopía de emisión atómica de plasma acoplado inductivamente () Este resultado es consistente con el estudio de Setbon et al. [ 44 ] que observó que los polvos BD contenían más elementos de calcio que MM-MTA, mientras que Abu Zeid et al. [ 45 ] mostró que, en comparación con ProRoot MTA, las muestras de Biodentina exhibieron una mayor liberación de calcio durante los 28 días utilizando la misma prueba. Por otro lado, se liberó una cantidad ligeramente mayor de calcio de la masilla ESRRM que de BD en todos los períodos de tiempo, sin diferencias estadísticamente significativas, y esto concuerda con estudios previos [ 46 , 47 ].
La cantidad acumulada de Ca 2+ liberada de la masilla ESRRM y BD fue mucho mayor (2336.4 mg / L y 2257.29 mg / L, respectivamente) que la de MM-MTA (1002.42 mg / L), después de 28 días. Una posible explicación de la alta cantidad de Ca 2+ liberada por los cementos de silicato de calcio podría estar asociada con el fraguado y las reacciones de hidratación. En 24 horas, la masilla ESRRM presentó la tasa más alta de liberación de Ca 2+ , y este hecho podría estar relacionado con el tiempo necesario para el fraguado final de este material que ocurre después de casi 200 minutos en un medio húmedo [ 48 ]. Además, el alto Ca +2las liberaciones en BD pueden correlacionarse con la presencia de un componente de silicato de calcio; El cloruro de calcio agiliza la reacción de hidratación y favorece la deposición de fosfato de calcio, al tiempo que mantiene un pH alto sin alterar la biocompatibilidad [ 49 ]. Además, se demostró que la presencia de carbonato de calcio desempeña un papel activo en la reacción de hidratación [ 50 ] al proporcionar sitios de nucleación, acelerando así la cinética de ajuste [ 51 ].
Aunque estos elementos también estaban presentes en MM-MTA, la cantidad de iones de calcio liberados por MM-MTA disminuyó durante los períodos de tiempo y la lixiviación fue menor en comparación con la masilla ESRRM y BD. Esto puede estar relacionado con la ausencia de silicato dicálcico en la masilla BD y ESRRM, que se sabe que está asociada con una reacción de hidratación más lenta y baja solubilidad [ 52 ].
5. Conclusión
Dentro de las limitaciones de este estudio in vitro, tres cementos probados (MM-MTA, masilla ESRRM y BD) demostraron el potencial de bioactividad al producir cristales de apatita y una capa interfacial en la dentina del conducto radicular en el fluido corporal simulado.
Disponibilidad de datos
Los datos utilizados para respaldar los hallazgos de este estudio están disponibles a través del autor correspondiente, previa solicitud.
Conflictos de interés
Los autores declaran que no existen conflictos de intereses con respecto a la publicación de este artículo.
Referencias
- KF Lovato y CM Sedgley, "Actividad antibacteriana del material de reparación de raíz Endosequence y ProRoot MTA contra aislados clínicos de Enterococcus faecalis ", Journal of Endodontia , vol. 37, no. 11, págs. 1542-1546, 2011.Ver en: Sitio del editor | Google Académico
- JL Ferracane, PR Cooper y AJ Smith, "¿Puede la interacción de los materiales con el complejo dentina-pulpa contribuir a la regeneración de la dentina?" Odontología , vol. 98, no. 1, págs. 2-14, 2010.Ver en: Sitio del editor | Google Académico
- N. Sarkar, R. Caicedo, P. Ritwik, R. Moiseyeva e I. Kawashima, "Base fisicoquímica de las propiedades biológicas del agregado de trióxido mineral", Journal of Endodontia , vol. 31, no. 2, págs. 97–100, 2005.Ver en: Sitio del editor | Google Académico
- TB Bozeman, RR Lemon y PD Eleazer, "Análisis elemental del precipitado cristalino de MTA gris y blanco", Journal of Endodontia , vol. 32, no. 5, págs. 425–428, 2006.Ver en: Sitio del editor | Google Académico
- JF Reyes-Carmona, MS Felippe y WT Felippe, "Capacidad de biomineralización e interacción de agregado de trióxido mineral y cemento Portland blanco con dentina en un fluido que contiene fosfato", Journal of Endodontia , vol. 35, no. 5, págs. 731–736, 2009.Ver en: Sitio del editor | Google Académico
- MG Gandolfi, P. Taddei, A. Tinti y C. Prati, "Capacidad de formación de apatita (bioactividad) de ProRoot MTA", International Endodontic Journal , vol. 43, no. 10, págs. 917–929, 2010.Ver en: Sitio del editor | Google Académico
- L. Han, T. Okiji y S. Okawa, "Análisis morfológico y químico de diferentes precipitados en agregado de trióxido mineral sumergido en diferentes fluidos", Dental Materials Journal , vol. 29, no. 5, págs. 512-517, 2010.Ver en: Sitio del editor | Google Académico
- L. Han y T. Okiji, "Evaluación de bioactividad de tres materiales endodónticos basados en silicato de calcio", International Endodontic Journal , vol. 46, no. 9, págs. 808–814, 2013.Ver en: Sitio del editor | Google Académico
- T. Kokubo y H. Takadama, "¿Qué tan útil es SBF para predecir la bioactividad ósea in vivo?" Biomateriales , vol. 27, no. 15, págs. 2907–2915, 2006.Ver en: Sitio del editor | Google Académico
- G. Bogen, JS Kim y LK Bakland, "Recubrimiento pulpar directo con agregado de trióxido mineral: un estudio de observación", Journal of the American Dental Association (1939) , vol. 139, no. 3, págs. 305–315, 2008.Ver en: Sitio del editor | Google Académico
- B. Karabucak, D. Li, J. Lim y M. Iqbal, "Terapia de pulpa vital con agregado de trióxido mineral", Dental Traumatology , vol. 21, no. 4, págs. 240–243, 2005.Ver en: Sitio del editor | Google Académico
- MG Gandolfi, S. Pagani, F. Perut et al., "Cementos innovadores a base de silicato para endodoncia: un estudio de la respuesta celular similar a los osteoblastos", Journal of Biomedical Materials Research. Parte A , vol. 87, no. 2, págs. 477–486, 2008.Ver en: Sitio del editor | Google Académico
- I. Islam, HK Chng y AU Jin Yap, "Comparación de las propiedades físicas y mecánicas de MTA y cemento Portland", Journal of Endodontia , vol. 32, no. 3, págs. 193–197, 2006.Ver en: Sitio del editor | Google Académico
- M. Fridland y R. Rosado, "Solubilidad MTA: un estudio a largo plazo", Journal of Endodontia , vol. 31, no. 5, págs. 376–379, 2005.Ver en: Sitio del editor | Google Académico
- M. Torabinejad, C. Hong, F. Mcdonald y T. Pittford, "Propiedades físicas y químicas de un nuevo material de relleno del extremo de la raíz", Journal of Endodontia , vol. 21, no. 7, págs. 349–353, 1995.Ver en: Sitio del editor | Google Académico
- PL Tomson, LM Grover, PJ Lumley, AJ Sloan, AJ Smith y PR Cooper, "Disolución de componentes de matriz de dentina bioactivos por agregado de trióxido mineral", Journal of Dentistry , vol. 35, no. 8, págs. 636-642, 2007.Ver en: Sitio del editor | Google Académico
- JE Gomes-Filho, G. Rodrigues, S. Watanabe et al., "Evaluación de la reacción tisular al cemento endodóntico rápido (CER) y Angelus MTA", Journal of Endodontia , vol. 35, no. 10, págs. 1377-1380, 2009.Ver en: Sitio del editor | Google Académico
- S. Köseoğlu, T. Pekbağryank, E. Kucukyilmaz, M. Sağlam, S. Enhos y A. Akgün, "Respuesta biológica de diferentes cementos a base de silicato tricálcico y cemento puzolánico disponibles comercialmente", Microscopy Research and Technique , vol. 80, no. 9, págs. 994–999, 2017.Ver en: Sitio del editor | Google Académico
- SS Raghavendra, GR Jadhav, KM Gathani y P. Kotadia, "Bioceramics in endodontics: a review", Revista de la Facultad de Odontología de la Universidad de Estambul , vol. 51, 3 Supl. 1, págs. 128–137, 2017.Ver en: Google Académico
- H. Shafaee, M. Alirezaie, A. Rangrazi, y E. Bardideh, “Comparación de la tasa de éxito de un sustituto dentina bioactivo con las de otros materiales de restauración raíz en pulpotomía de los dientes primarios: revisión sistemática y meta-análisis,” Diario de la Asociación Dental Americana (1939) , vol. 150, no. 8, págs. 676–688, 2019.Ver en: Sitio del editor | Google Académico
- LAB Silva, KAMG Pieroni, P. Nelson-Filho et al., "Perforación de la furca: respuesta del tejido perirradicular a Biodentine como material de reparación mediante análisis de inmunofluorescencia histopatológica e indirecta", Journal of Endodontia , vol. 43, no. 7, págs. 1137-1142, 2017.Ver en: Sitio del editor | Google Académico
- S. Rajasekharan, LC Martens, RGEC Cauwels y RMH Verbeeck, "Características del material Biodentine ™ y aplicaciones clínicas: una revisión de la literatura", European Archives of Pediatric Dentistry , vol. 15, no. 3, págs. 147-158, 2014.Ver en: Sitio del editor | Google Académico
- T. Charland, GR Hartwell, C. Hirschberg y R. Patel, "Una evaluación del tiempo de fraguado del agregado de trióxido mineral y el material de reparación de raíz EndoSequence en presencia de sangre humana y medios esenciales mínimos", Journal of Endodontia , vol. 39, no. 8, págs. 1071-1072, 2013.Ver en: Sitio del editor | Google Académico
- D. Tran, J. He, GN Glickman y KF Woodmansey, "Análisis comparativo de materiales de relleno de raíces a base de silicato de calcio utilizando un modelo de ápice abierto", Journal of Endodontia , vol. 42, no. 4, págs. 654–658, 2016.Ver en: Sitio del editor | Google Académico
- L. Han y T. Okiji, "La absorción de calcio y silicio liberado de los materiales endodónticos a base de silicato de calcio en la dentina del conducto radicular", International Endodontic Journal , vol. 44, no. 12, págs. 1081-1087, 2011.Ver en: Sitio del editor | Google Académico
- R. Grazziotin-Soares, MH Nekoofar, TE Davies et al., "Efecto del óxido de bismuto en el agregado de trióxido mineral blanco: caracterización química y propiedades físicas", International Endodontic Journal , vol. 47, no. 6, págs. 520-533, 2014.Ver en: Sitio del editor | Google Académico
- MRC Marques, R. Loebenberg y M. Almukainzi, "Fluidos biológicos simulados con posible aplicación en pruebas de disolución", Dissolution Technologies , vol. 18, no. 3, págs. 15–28, 2011.Ver en: Sitio del editor | Google Académico
- FR Tay, DH Pashley, FA Rueggeberg, RJ Loushine y RN Weller, "Transformación de fase de fosfato de calcio producida por la interacción del componente de cemento Portland del agregado de trióxido mineral blanco con un fluido que contiene fosfato", Journal of Endodontia , vol. 33, no. 11, págs. 1347-1351, 2007.Ver en: Sitio del editor | Google Académico
- N. Shokouhinejad, MH Nekoofar, H. Razmi et al., "Bioactividad del material de reparación de raíz EndoSequence y bioaggregate", International Endodontic Journal , vol. 45, no. 12, págs. 1127-1134, 2012.Ver en: Sitio del editor | Google Académico
- I. Khalil, A. Naaman y J. Camilleri, "Investigación de un nuevo agregado de trióxido mineral mezclado mecánicamente (MM-MTA (™))", International Endodontic Journal , vol. 48, no. 8, págs. 757–767, 2015.Ver en: Sitio del editor | Google Académico
- J. Camilleri, "Mecanismos de hidratación del agregado de trióxido mineral", International Endodontic Journal , vol. 40, no. 6, págs. 462-470, 2007.Ver en: Sitio del editor | Google Académico
- MG Gandolfi, G. Ciapetti, P. Taddei et al., "La formación de apatita en cementos bioactivos de silicato de calcio para odontología afecta la topografía de la superficie y la proliferación de células del estroma de la médula humana", Dental Materials , vol. 26, no. 10, págs. 974–992, 2010.Ver en: Sitio del editor | Google Académico
- M. Parirokh y M. Torabinejad, "Agregado de trióxido mineral: una revisión exhaustiva de la literatura, parte III: aplicaciones clínicas, inconvenientes y mecanismo de acción", Journal of Endodontia , vol. 36, no. 3, págs. 400-413, 2010.Ver en: Sitio del editor | Google Académico
- MG Gandolfi, AP Parrilli, M. Fini, C. Prati y PMH Dummer, "Análisis de micro-CT 3D de los huecos de interfaz asociados con los rellenos de raíz Thermafil utilizados con AH Plus o un sellador MTA fluido", International Endodontic Journal , vol. 46, no. 3, págs. 253–263, 2013.Ver en: Sitio del editor | Google Académico
- JR Kim, A. Nosrat y AF Fouad, "Características de la interfaz de Biodentine y MTA con dentina en fluido corporal simulado", Journal of Dentistry , vol. 43, no. 2, págs. 241–247, 2015.Ver en: Sitio del editor | Google Académico
- D. Tadic, F. Peters y M. Epple, "Síntesis continua de apatitas carbonatadas amorfas" , Biomaterials , vol. 23, no. 12, págs. 2553–2559, 2002.Ver en: Sitio del editor | Google Académico
- NJ Coleman, JW Nicholson y K. Awosanya, "Una investigación preliminar de la bioactividad in vitro del cemento Portland blanco", Cement and Concrete Research , vol. 37, no. 11, págs. 1518-1523, 2007.Ver en: Sitio del editor | Google Académico
- Q. Yang, T. Troczynski y D.-M. Liu, "Influencia de las semillas de apatita en la síntesis de cemento de fosfato de calcio" , Biomaterials , vol. 23, no. 13, págs. 2751–2760, 2002.Ver en: Sitio del editor | Google Académico
- CP Lucas, R. Viapiana, R. Bosso-Martelo, JM Guerreiro-Tanomaru, J. Camilleri y M. Tanomaru-Filho, "Propiedades fisicoquímicas y fuerza de unión a la dentina de un material retrógrado a base de silicato tricálcico", Brazilian Dental Journal , vol. 28, no. 1, págs. 51–56, 2017.Ver en: Sitio del editor | Google Académico
- GT de Miranda Candeiro, FC Correia, MAH Duarte, DC Ribeiro-Siqueira y G. Gavini, "Evaluación de la radiopacidad, el pH, la liberación de iones de calcio y el flujo de un sellador de conductos radiculares biocerámicos", Journal of Endodontia , vol. 38, no. 6, págs. 842–845, 2012.Ver en: Sitio del editor | Google Académico
- F. Zamparini, F. Siboni, C. Prati, P. Taddei y MG Gandolfi, "Propiedades de los materiales de silicato de calcio-fosfato de calcio monobásico para endodoncias que contienen pentóxido de tantalio y óxido de circonio", Clinical Oral Investigations , vol. 23, no. 1, págs. 445–457, 2019.Ver en: Sitio del editor | Google Académico
- GW Lee, JH Yoon, JH Jang et al., "Efectos del material de relleno retrógrado recientemente desarrollado sobre la diferenciación osteoblástica in vitro ", Dental Materials Journal , vol. 38, no. 4, págs. 528-533, 2019.Ver en: Sitio del editor | Google Académico
- J. Camilleri, F. Sorrentino y D. Damidot, "Investigación de la hidratación y la bioactividad del cemento de silicato tricálcico radiopacificado, Biodentine y MTA Angelus", Dental Materials , vol. 29, no. 5, págs. 580–593, 2013.Ver en: Sitio del editor | Google Académico
- HM Setbon, J. Devaux, A. Iserentant, G. Leloup y JG Leprince, "Influencia de la composición en la cinética de fraguado de nuevos cementos de silicato tricálcico inyectables y / o de fraguado rápido", Dental Materials , vol. 30, no. 12, págs. 1291–1303, 2014.Ver en: Sitio del editor | Google Académico
- STH Abu Zeid, OS Alothmani y MK Yousef, "Biodentina y agregado de trióxido mineral: un análisis de solubilidad, cambios de pH y elementos de lixiviación", Life Science Journal , vol. 12, no. 4, págs. 18–23, 2015.Ver en: Google Académico
- N. Thanavibu, A. Panichuttra y R. Chootima, "Efectos de la contaminación sanguínea en la formación de apatita, pH y liberación de iones de tres materiales basados en silicato de calcio", The Journal of the Dental Association of Thailand , vol. 69, no. 3, págs. 324–333, 2019.Ver en: Google Académico
- A. Koutroulis, SA Kuehne, PR Cooper y J. Camilleri, "El papel de la liberación de iones de calcio en la biocompatibilidad y las propiedades antimicrobianas de los cementos hidráulicos", Scientific Reports , vol. 9, no. 1, p. 19019, 2019.Ver en: Sitio del editor | Google Académico
- YJ Guo, TF Du, HB Li et al., "Propiedades físicas y comportamiento de hidratación de un material endodóntico biocerámico de fraguado rápido", BMC Oral Health , vol. 16, no. 1, págs. 1-6, 2016.Ver en: Sitio del editor | Google Académico
- EA Bortoluzzi, NJ Broon, CM Bramante, WT Felippe, MT Filho y RM Esberard, "La influencia del cloruro de calcio en el tiempo de fraguado, solubilidad, desintegración y pH del agregado de trióxido mineral y cemento Portland blanco con un radiopacificador", Journal de Endodoncia , vol. 35, no. 4, págs. 550–554, 2009.Ver en: Sitio del editor | Google Académico
- T. Matschei, B. Lothenbach y FP Glasser, "El papel del carbonato de calcio en la hidratación del cemento", Cement and Concrete Research , vol. 37, no. 4, págs. 551–558, 2007.Ver en: Sitio del editor | Google Académico
- L. Grech, B. Mallia y J. Camilleri, "Investigación de las propiedades físicas de los materiales de relleno de extremo de raíz a base de cemento de silicato tricálcico", Dental Materials , vol. 29, no. 2, págs. E20 – e28, 2013.Ver en: Sitio del editor | Google Académico
- BW Darvell y RCT Wu, ““ MTA ”: un cemento de silicato hidráulico: revisión de actualización y reacción de fraguado” , Materiales dentales , vol. 27, no. 5, págs. 407–422, 2011.Ver en: Sitio del editor | Google Académico
Derechos de autor
Copyright © 2020 Ranjdar Mahmood Talabani et al. Este es un artículo de acceso abierto distribuido bajo la Licencia de Atribución Creative Commons , que permite el uso, la distribución y la reproducción sin restricciones en cualquier medio, siempre que el trabajo original se cite correctamente.