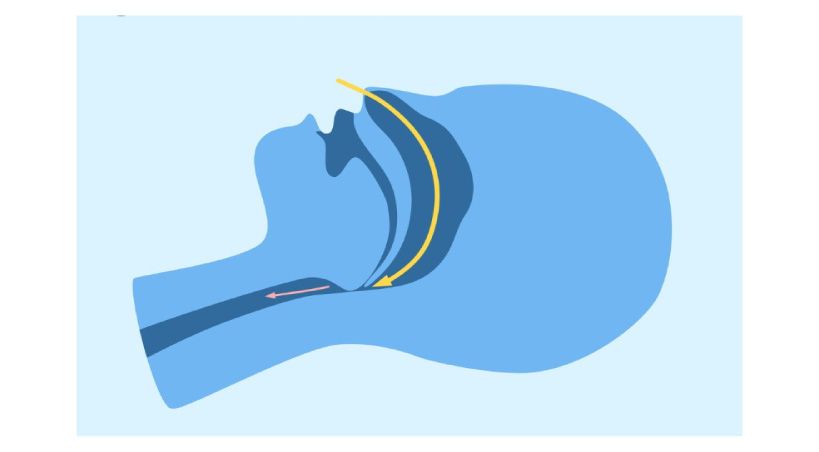
Apnea obstructiva del sueño
Mar 30 de 2024 0
Autor/a: Loutfi S. Aboussouan, Aparna Bhat, Todd Coy y Alan Kominsky Clinic Journal of Medicine Volume 90 Number 12 December 2023
La presión positiva continua en la vía aérea (CPAP, por sus siglas en inglés) sigue siendo el tratamiento de referencia para la apnea obstructiva del sueño(AOS) pero no es el único.
Para algunos pacientes, pueden ser más adecuados los tratamientos alternativos ya que se trata de un trastorno heterogéneo con diferencias clínicas, polisomnográficas y fisiológicas. En esta revisión se presentan métodos de tratamiento para la AOS de tipo conservador; basados en la presión y, quirúrgicos incluidas sus indicaciones, eficacia, advertencias y cuáles son los pacientes que podrían ser más beneficiados.
Diagnóstico basado en el índice apnea-hipopnea
La American Academy of Sleep Medicine fundamenta el diagnóstico de AOS en el índice de apnea-hipopnea (IAH), es decir, el número de eventos respiratorios obstructivos (apnea, hipopnea o excitación respiratoria relacionada con el esfuerzo) por hora de sueño, definido como uno de los siguientes:
• ≥15 eventos/hora, independientemente de los síntomas o comorbilidades
• ≥5 eventos/hora con síntomas clínicamente significativos (por. ej., somnolencia diurna, ronquidos fuertes, apneas presenciadas, despertares nocturnos con ahogo o jadeos) o comorbilidades (por ej., hipertensión, enfermedades cardíacas, diabetes, discapacidad cognitiva).
El ensayo de cohorte Wisconsin Sleep Cohort Study informó que entre 2007 y 2010, el 26% de las personas de 30 a 70 años tenían un IAH de al menos 5, mientras que casi el 10% tenía un IAH de al menos 15 (que representa una AOS moderada o grave), y que éstos fueron aumentos "sustanciales" en comparación con las estimaciones entre 1988 y 1994.
La AOS no tratada causa problemas durante el día, como somnolencia en más de la mitad de los pacientes, con aumento del 17% del riesgo de accidentes automovilísticos.
Las consecuencias a largo plazo incluyen hipertensión, diabetes incidental, eventos cardiovasculares y deterioro en varios dominios de la cognición, incluyendo la atención, la memoria y la función ejecutiva. Afortunadamente, dicen los autores, el riesgo de estas complicaciones es modificable con terapia.
Tratamientos conservadores
Como complementos de la CPAP, la terapia generalmente incluye pérdida de peso, ejercicio, terapia postural y evitación del alcohol, pero existen otros tratamientos conservadores alternativos.
> Pérdida de peso
El índice de masa corporal (IMC) es un predictor importante de AOS y ocupa un lugar destacado en las escalas de predicción. Por el contrario, en un estudio longitudinal, una pérdida de peso del 10% predijo una disminución del 26% del IAH. La pérdida de peso disminuye la capacidad de colapso de la vía aérea medida por la presión crítica de cierre de la faringe, con la resolución casi completa de la apnea cuando la presión crítica de cierre faríngea cae por debajo de –4 cm H2O.
> Modificaciones del estilo de vida. En un gran estudio aleatorizado a largo plazo de pacientes con obesidad, diabetes y AOS, la tasa de remisión de la AOS a los 10 años fue del 34,4% con intervenciones intensivas en el estilo de vida en comparación con el tratamiento de soporte y la educación de la diabetes solo en el 22,2%. La mejoría de la gravedad de la AOS se relacionó con el cambio en el peso corporal y el IAH original.
La cirugía bariátrica puede mejorar significativamente la AOS, con tasas de curación reportadas del 86%, 57% y 45%. Sin embargo, en un estudio, la AOS moderada o grave persistió en el 20% de los pacientes después de la cirugía.
En el ensayo, la reducción del IAH, estadísticamente no mostró un aumento significativo con el uso del cinturón gástrico que con la pérdida de peso convencional, aunque el adelgazamiento de los pacientes con banda gástrica fue mayor. Por lo tanto, es necesario tener en cuenta que la cirugía bariátrica no puede curar la AOS. Los autores sostienen que éste es un tema que debería ser discutido antes de la cirugía. En otro estudio, la adherencia a la CPAP fue deficiente después de la cirugía bariátrica (los pacientes usaron sus máquinas en una media de solo el 49% de las noches).
Los agonistas del receptor 1 del péptido símil glucagón frenan el apetito y el hambre, reducen la salida de alimentos del estómago, promueven la plenitud posprandial y han sido muy eficaces para promover la pérdida de peso. En un estudio también se comprobó que disminuyeron el IAH en 6 episodios/hora más que con el placebo. Dos fármacos de esta clase, la liraglutida y la semaglutida, están aprobados por la FDA de EE. UU. para controlar crónicamente el peso. Sin embargo, no hay medicamentos aprobados específicamente para el tratamiento de la AOS.
> Ejercicio
Aún no se sabe si por sí solo el ejercicio mejora la AOS. En el estudio AHEAD (Action for Health in Diabetes) en el que se hicieron intervenciones en el estilo de vida que incluyen el ejercicio en pacientes con obesidad y diabetes mellitus, el IAH disminuyó, independientemente de la modificación del peso. De manera similar, en un metanálisis, se descubrió que el ejercicio mejora la AOS aún antes cambios de peso mínimos. Por el contrario, en otro estudio de adultos con sobrepeso, diabetes y AOS, la aptitud física no cambió la gravedad de la AOS después de tener en cuenta el cambio de peso. Aun así, los autores recomiendan el ejercicio a pacientes con AOS porque pueden modificar favorablemente los riesgos cardiovasculares asociados.
> Terapia postural del sueño
Se ha observado que el IAH es 2 veces mayor cuando las personas duermen boca arriba que cuando duermen de costado. El aumento del IAH en posición reclinada fue más prominente en las personas con menos obesidad y peso casi normal. Los pacientes con apnea del sueño posicional tendían a tener un IMC y un IAH general más bajos que aquellos con AOS no postural.
La terapia postural utiliza una variedad de dispositivos o prendas para mantener a los pacientes alejados de su espalda durante la noche, como las camisetas de pijama con un bulto o una pelota de tenis cosida a la parte de atrás. Una revisión de Cochrane no halló diferencias en el puntaje de la Escala de Somnolencia de Epworth, calidad de vida o calidad del sueño entre los resultados de la CPAP y la terapia postural. Se constataron 6,4 eventos/hora menos con CPAP, pero la adherencia fue 2,5 horas/noche más con la terapia postural.
Comparado con los puntajes en un grupo de control, la terapia postural mejoró el puntaje de la escala de somnolencia de Epworth en 1,58 puntos (una diferencia que no se considera clínicamente importante), y redujo la AOS en 7,4 eventos/hora, pero el 10% de los pacientes todavía tenía alteraciones del sueño y molestias en la espalda o el pecho.
> Abstinencia de alcohol
En los metanálisis, la prevalencia de la AOS fue un 25% mayor en las personas que consumían alcohol, la duración de la apnea fue mayor y el nadir de la saturación de oxígeno fue menor. Estos efectos pueden estar mediados por un efecto adverso selectivo del alcohol sobre los músculos dilatadores de las vías respiratorias, con depresión de la actividad del nervio hipogloso o del músculo geniogloso y sin cambios en el patrón respiratorio, la ventilación minuto o la respuesta ventilatoria hipercápnica.
El efecto del alcohol sobre la AOS parece ser particularmente pronunciado en aquellos que roncan o que sufren apnea del sueño y en los hombres, lo que quizás sea el reflejo de un posible efecto protector de la progesterona.
> Terapia farmacológica no aprobada
Actualmente no hay ningún medicamento aprobado o de uso común para el manejo de la AOS.
La evidencia hallada por una revisión de Cochrane en 2013 fue insuficiente para recomendar cualquier medicamento para la AOS. Dicho esto, se ha comprobado que los antidepresivos protriptilina como la fluoxetina reducen el número de eventos de apnea e hipopnea, en parte por su efecto esperado de reducir el movimiento ocular rápido (REM), pero también por una reducción de los eventos del sueño no REM. Sin embargo, la respuesta fue variable y los fármacos no disminuyeron el número de excitación o eventos de desaturación.
Los inhibidores de la anhidrasa carbónica, como la acetazolamida, la zonisamida y el topiramato pueden reducir el IAH (en un 42% en un estudio de acetazolamida) y mejorar la eficiencia del sueño y la saturación de oxígeno pero no la somnolencia. El mecanismo puede estar relacionado con la estimulación de la respiración y la reducción de la sensibilidad del control ventilatorio más que mejorar el colapso de las vías respiratorias.
Por ejemplo, la reducción del IAH se correlaciona con la reducción de la concentración de bicarbonato y con la reducción de la ganancia del bucle (mejorando la respuesta ventilatoria exagerada al reanudar la respiración después de un evento obstructivo). Cuando los inhibidores de la anhidrasa carbónica se combinan con la CPAP, el IAH se reduce particularmente. La guía de la European Respiratory Society tiene una recomendación condicional basada en evidencia de baja calidad para utilizar los inhibidores de la anhidrasa carbónica, pero solo en el contexto de un ensayo controlado aleatorizado.
Una estrategia más nueva es contrarrestar 2 mecanismos de hipotonía faríngea, es decir, pérdida del impulso noradrenérgicos e inhibición muscarínica activa, usando una combinación de agentes noradrenérgicos y antimuscarínicos como atomoxetina con oxibutinina, reboxetina con oxibutinina o, atomoxetina con fesoterodina. Si bien ningún tipo de agente por sí solo redujo el IAH, la combinación puede resultar en más del 50% de reducción a corto plazo del impulso, aunque el éxito puede depender de elegir a pacientes con un fenotipo de colapsabilidad de las vías respiratoria superiores más leve. Las combinaciones de estos agentes pueden ser prometedoras, pero actualmente no están disponibles.
> Oxígeno
Aunque a veces se prescribe oxígeno empíricamente como terapia alternativa para pacientes que no pueden o no quieren utilizar CPAP, su uso no está justificado para ese fin.
En un metanálisis de estudios controlados aleatorizados que compararon CPAP y oxígeno nocturno se comprobó que las intervenciones mejoraron de manera similar la desaturación nocturna de oxígeno, pero la oxigenoterapia prolongó la duración de los eventos respiratorios relacionados con el sueño, pudo haber promovido la hipercapnia y no mejoró la somnolencia. Por otra parte, en los pacientes con AOS y enfermedad cardiovascular o factores de riesgo cardiovascular, la suplementación con oxígeno no redujo la presión arterial mientras que la CPAP sí.
Estos hallazgos no excluyen el uso de oxígeno en pacientes con rasgos endofenotípicos específicos de apnea del sueño. Por ejemplo, un modelo multivariable halló que la suplementación de oxígeno produjo mayor ganancia de bucle y disminuyó la colapsabilidad o el aumento de la compensación faríngea como predictor de una disminución del IAH.
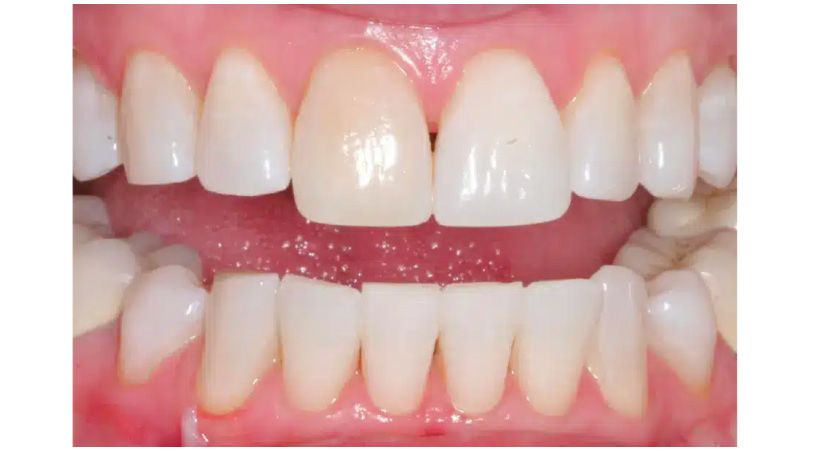
> Aparatos bucales
Los aparatos bucales pueden ser una alternativa eficaz para muchos pacientes con AOS. Estos dispositivos estabilizan y hacen avanzar la mandíbula hacia delante para abrir las vías respiratorias, especialmente hacia los lados en el área velofaríngea. Un aparato bucal puede ser una primera opción terapéutica para la AOS leve a moderada y, para la AOS grave cuando el paciente no puede tolerar o rechaza la CPAP.
Una vez confirmada la AOS, el paciente debe ser evaluado por un dentista calificado para determinar si es candidato para portar un aparato bucal basándose en la salud y el trabajo dental existentes, la relación del maxilar con la mandíbula, el rango de movimiento mandibular y, los antecedentes de trastornos temporomandibulares.
El dispositivo hecho a medida coloca la mandíbula en una posición inicial cómoda según lo determinado por el dentista y el paciente. Luego, el dispositivo puede ser calibrado en base a las respuestas subjetivas y objetivas dentro de un rango cómodo para el paciente. Cuando el paciente logra la resolución de los síntomas de apnea, el médico remitente es notificado y puede confirmar la eficacia terapéutica.
El éxito del tratamiento con aparatos bucales puede ser medido de varias maneras, pero a menudo se calcula por una disminución el IAH de al menos el 50%. En un estudio, el uso de este aparato bucal métrico fue efectivo en el 68% de 172 pacientes después de 2 años de tratamiento. En otro estudio, la tasa de éxito fue del 69%, definiéndose el éxito como al menos una reducción del 50% del IAH, junto con un IAH <10.
Muchos estudios han demostrado que los aparatos bucales pueden aliviar la somnolencia diurna y la confusión mental, reducir la hipertensión arterial y el riesgo de muertes cardiovasculares relacionadas.
Los pacientes deben ser atendidos por un dentista calificado cada, 6 meses durante el primer año de terapia con aparatos bucales y luego anualmente. El seguimiento es esencial para monitorear a los pacientes, para detectar cualquier cambio en el sueño, así como cualquier efecto secundario relacionado con el dispositivo, como cambios en la oclusión o la posición de los dientes, dolor de mandíbula, trastornos de las articulaciones temporomandibulares y daños del trabajo dental existente.
> Terapia miofuncional
Esta terapia consiste en intervenciones tales como la estimulación eléctrica de la lengua, la logopedia, la respiración circular, cantar o ejecutar un instrumento de viento, lo que fortalecen la cara, la lengua, las estructuras orofaríngeas o esqueléticas y mejora los mecanismos compensatorios neuromusculares que contrarrestan las cargas mecánicas anatómicas que contribuyen al estrechamiento de las vías respiratorias. Un grupo de trabajo europeo no recomienda la terapia miofuncional como tratamiento estándar de la AOS, por sus limitaciones y evidencia de baja calidad. Sin embargo, puede ser útil para los pacientes que buscan alternativas a las opciones quirúrgica o mecánica más eficaces.
En una revisión sistemática, la terapia miofuncional disminuyó el IAH en un 50% con mejoría en el nadir de saturación de oxígeno, ronquidos y somnolencia diurna. La FDA de EE. UU. ha aprobado un dispositivo eléctrico de estimulación de la lengua (eXciteOSA) para ronquidos y AOS leve que mejora objetivamente los ronquidos, la somnolencia, la calidad de vida relacionada con el sueño y el IAH (de 10,2 a 6,8 eventos/hora). Un papel adicional de la terapia miofuncional puede ser como complemento de la CPAP para mejorar la adherencia a la CPAP, con posibles beneficios incrementales en comparación con la CPAP sola.
Terapia de presión en las vías aéreas
Varios tipos de máquinas previenen eventos obstructivos manteniendo las vías respiratorias abiertas.
> El pilar de esta terapia es la CPAP
La CPAP es un tratamiento de primera línea para la AOS moderada o grave y para la AOS asociada a comorbilidades o factores de riesgo cardiovasculares.
Las máquinas de CPAP aplican una columna de aire con presión positiva para dilatar las vías respiratorias superiores y reducir el IIA, a menudo hasta lo normal. La CPAP se considera el estándar de atención según su efectividad para mejorar el control de la presión arterial, la calidad de vida relacionada con el sueño y la somnolencia diurna, aunque sus efectos sobre el riesgo cardiovascular y el control de la glucemia están menos bien establecidos.
La presión arterial se reduce incluso en pacientes con hipertensión resistente. Hay pruebas contradictorias sobre el impacto de la terapia con CPAP en la cognición. Algunos estudios demostraron una señal hacia una mejoría leve y transitoria de la función cognitiva ejecutiva y cognitiva del lóbulo frontal únicamente en pacientes con AOS grave. En la AOS sintomática leve, si el paciente tiene somnolencia diurna se recomienda la CPAP, ya que puede mejorar la calidad de vida. En un paciente con AOS leve asintomática, la decisión de utilizar CPAP estaría basada en una discusión con el paciente sobre la reducción potencial del riesgo cardiovascular.
El uso de la CPAP, especialmente en las primeras semanas, permite predecir el éxito a largo plazo. Lo ideal es que los pacientes deben usar su dispositivo durante todo el período de sueño. Varios son los factores que se pueden abordar para mejorar la comodidad y el cumplimiento del paciente, incluido el tipo de máscara, el alivio de la presión espiratoria, el uso a corto plazo de hipnóticos, terapia cognitivo-conductual y contacto frecuente con el equipo de salud, con educación continua sobre los beneficios esperados. La mala adherencia a la CPAP sigue siendo preocupante. Estudios recientes informaron que el cumplimiento a los 90 días y aún al año fue de casi el 75%, lo cual es significativamente mejor que los datos anteriores.
Aunque a menudo la CPAP se promociona como un facilitador de la pérdida de peso, existe una considerable controversia al respecto y estudios más amplios y bien realizados sugieren que puede causar aumento de peso como efecto secundario debido a una reducción de las tasas metabólicas durante el sueño y la vigilia y aumento de la ingesta calórica.
La presión positiva en las vías respiratorias automática o con autotitulación (APAP) está ganando popularidad, ya que permite prescribir un rango de presiones que el dispositivo puede utilizar para endoprótesis en las vías respiratorias basadas en algoritmos patentados. El rango de presión también puede ser ajustado en el paciente ambulatorio según los informes de cumplimiento descargados del dispositivo real.
Los beneficios potenciales de la APAP incluyen un costo general más bajo con un inicio más rápido de la terapia, ya que no hay necesidad de un estudio de titulación. Por lo tanto, estos estudios son cada vez menos comunes, aunque siguen siendo útiles para definir un rango de presión de la APAP para cumplir con los requisitos de los seguros o ayudar en la elección adecuada del dispositivo y los ajustes de la presión en los casos más complejos.
La presión positiva de dos niveles en las vías respiratorias no tiene tasas de adherencia claramente mejores que la CPAP, pero debería ser considerada para pacientes con trastornos respiratorios del sueño asociados a hipercapnia diurna, hipoventilación relacionada con el sueño, eventos de apnea mixta obstructiva y central o requerimiento de alta presión o, en aquellos que no pueden tolerar presiones respiratorias elevadas.
> Dispositivo nasal de presión positiva espiratoria en las vías respiratorias
Los dispositivos nasales de presión de las vías respiratorias espiratorias (EPAP, por sus siglas en inglés) son alternativas a la CPAP para pacientes con AOS moderada o leve. Esos dispositivos generan una resistencia al flujo espiratorio y están asegurados a la nariz mediante inserciones nasales con arnés opcional (Bongo Rx), o almohadillas nasales con arnés (OptiPillows, ULTepap).
A diferencia de la CPAP, que proporciona una presión continua durante la inspiración y espiración, la contrapresión generada por la EPAP está presente solo durante la espiración con mínima resistencia inspiratoria. Algunos de estos dispositivos han sido aprobados por la FDA. La autorización para la AOS leve o moderada (Bongo Rx, ULTepap) y otros es solo para pacientes que roncan (Optipillows). En uno de los primeros estudios (1983), la EPAP a 10 cm H2O redujo el número de eventos de apnea, su duración y mejoramiento de la saturación nocturna.
En un ensayo aleatorizado de EPAP vs. tratamiento simulado, la mediana del IAH se redujo de 15,7 a 4,7 eventos/hora después de 1 año. Esta intervención funciona en diferentes niveles de gravedad de la AOS. Los candidatos ideales pueden ser aquellos con respiración alterada durante el sueño que tiene un componente posicional (peor en posición supina en comparación con la posición lateral). Sin embargo, un ensayo aleatorizado no halló beneficios de la EPAP en pacientes con AOS moderada a grave que habían discontinuado la CPAP.
> Terapia de presión negativa oral
Esta técnica aplica presión negativa a través de una interfaz intraoral mantenida en su lugar con una brida que se ajusta entre los dientes y los labios. El dispositivo iNAP está aprobado por la FDA para la apnea del sueño de cualquier gravedad. Este dispositivo mejora el tamaño de las vías respiratorias retropalatinas al desplazar hacia adelante el segmento anterosuperior de la lengua y en sentido anterior y superior al paladar blando.
La terapia de presión negativa oral puede ser más efectiva en la apnea del sueño con colapso retropalatino que con colapso de las vías respiratorias retrogloso, aunque esto no fue corroborado en otro estudio. En una revisión de la intervención, solamente el 25% al 37% de los pacientes mostraron al menos un 50% de reducción del IAH y un IAH residual ≤10, como así un número importante de pacientes todavía tenían AOS significativa. La gravedad inicial de la apnea del sueño no se correlacionó con el éxito.
> Presión externa negativa
La presión espiratoria negativa continua se aplica mediante un collar de silicona externo que se coloca alrededor de la parte anterior del cuello donde proporciona presión negativa para abrir la vía aérea retirando las estructuras de tejido blando. Como el collar no cubre ninguna estructura facial, puede ser que los pacientes se aclimaten más fácilmente y cumplan con la terapia.
La configuración del sistema se titula de manera similar a la CPAP aumentando la presión lo suficiente como para mantener las vías respiratorias abiertas superando los momentos críticos.
> Presión de cierre de las vías respiratorias
En un estudio piloto, 9 de 15 pacientes (60%) tuvieron una respuesta “excelente” a las presiones externas negativas continuas definida por la reducción del IAH a <5 eventos/hora (por debajo de una línea de base de 43,9.
Un dispositivo más nuevo puede variar la presión negativa externa durante toda la noche y está disponible en varios tamaños y formas del cuello. En un ensayo prospectivo abierto de este dispositivo, realizado en 28 pacientes con AOS moderada, 14 (50%) tuvieron una respuesta excelente y 6 (21%) una respuesta parcial (disminución del IAH de al menos 50% del basal). Estos dispositivos todavía no están disponibles para la práctica diría.
Opciones quirúrgicas
La cirugía para la AOS puede ser considerada cuando un paciente no ha tenido éxito con otras terapias. Antes de recurrir a la cirugía, la mayoría de los cirujanos realizan una endoscopia del sueño inducida por fármacos. Este procedimiento se realiza con el paciente sedado y dormido pero respirando espontáneamente. Se pueden identificar las áreas de obstrucción y colapso para determinar el tipo de cirugía que podría corregir estos hallazgos.
> Uvulopalatofaringoplastia
La cirugía para la AOS comenzó con interés a principios de la década de 1980 cuando, para tratar a los pacientes con apnea del sueño, Fujita adaptó un procedimiento utilizado para los ronquidos. Desde entonces, este procedimiento ha sido un pilar del tratamiento quirúrgico, con variaciones y mejoras a lo largo de los años que preservan más la mucosa y abordan el colapso de la pared lateral. Las tasas de éxito varían ya que cada cirujano utiliza una técnica diferente.
En un metaanálisis basado en 15 estudios observacionales (calidad de la evidencia “muy baja”), la reducción del IAH fue del 33%. Sin embargo, con el tiempo, el IAH tiende a aumentar nuevamente debido al aflojamiento del tejido cicatricial o los cambios en el peso corporal. En un metanálisis de 2 ensayos aleatorizados (nivel de evidencia “bajo”) se halló que la uvulopalatoplastia asistida por láser, una técnica alternativa, redujo el IAH en un 18%.
> Reducción de lengua
En un intento por mejorar los resultados de la uvulopalatofaringoplastia, los cirujanos comenzaron a hacer la reducción de la lengua, a través de varias maneras. La glosectomía de la línea media elimina una elipse de tejido en la superficie dorsal de la mitad de la lengua. El tratamiento por radiofrecuencia para reducir la cantidad de músculo de la lengua se puede hacer mediante la canalización dentro de la lengua o con puntas de aguja.
En un metanálisis de 8 estudios observacionales (nivel de evidencia “muy baja”), la reducción de la lengua por radiofrecuencia se asoció con una reducción del 34% del IAH. Para predecir el éxito de la con reducción de la lengua por radiofrecuencia a realzar, Friedman et al. crearon un sistema de estadificación basado en los hallazgos físicos como el puntaje de Mallampati modificado (evaluación del tamaño y forma de la lengua vs. la apertura orofaríngea) y el tamaño de las amígdalas. Los pacientes con una lengua pequeña y amígdalas grandes tenían mayor éxito mientras que los pacientes con una lengua grande y amígdalas pequeñas tuvieron tasas de éxito más bajas.
> Estimulación del nervio hipogloso
El último avance de la cirugía del sueño ha sido la estimulación del nervio hipogloso. El único sistema comercialmente disponible (Inspire) en EE. UU fue aprobado por la FDA en 2014 y desde publicación del ensayo Stimulation Therapy for Apnea Reduction ha ido ganando aceptación constantemente. El dispositivo consta de un generador de impulsos implantado, un cable de estimulación y un cable de sensor respiratorio. El generador de impulsos aumenta la entrada neuronal del nervio hipogloso a los músculos geniogloso y geniohioideo lo que resulta en una protrusión de la lengua hacia adelante con cada respiración detectada.
Las indicaciones han sido aprobadas por la FDA: para adultos ≥22 años. El candidato tiene que haber probado la CPAP sin éxito, tener un IAH entre 15 y 100 eventos//hora (sin la ocurrencia de más del 25% de eventos de apneas centrales o mixtas) y un IMC ≤40 kg/m2.
También se incluyen pacientes de 18 a 21 años con un IAH de 15 a 100, y pacientes pediátricos con síndrome de Down de 13 a 18 años y un IAH de 10 a 50 que no han sido tratados eficazmente o tienen una contraindicación para la adenoamigdalectomía y han fracasado o no pueden tolerar la terapia de presión positiva en las vías respiratorias. Una contraindicación es el colapso concéntrico. A medida que la experiencia y la tecnología mejoren, los criterios de elegibilidad seguirán cambiando.
Durante la cirugía de implante, para colocar el generador de impulsos y los 2 cables son suficientes3 incisiones, las cuales se hacen justo debajo de la línea de la mandíbula y en la parte superior del tórax. El procedimiento se realiza de forma ambulatoria, con el paciente bajo anestesia general. Una vez que se obtiene la configuración óptima del sistema mediante pruebas en el laboratorio de polisomnografía, el dispositivo se activa recién cuando el paciente se acuesta.
La estimulación del nervio hipogloso se asocia con gran adherencia y beneficios duraderos hasta los 5 años, evidenciado por el mejoramiento del puntaje de somnolencia de Epworth, los resultados informados por los pacientes, que son comparables a los de la CPAP y, por un IAH reducido.
Los resultados iniciales mostraron una reducción del 68% del IAH y una tasa de éxito del 66% (definida como un IAH <20 y al menos una reducción del 50% del IAH), pero con una mejorada técnica quirúrgica y mayor conocimiento de la programación del dispositivo. Las tasas de éxito han mejorado a 75% a 80%. El sexo femenino, el IMC basal más bajo, un IAH inicial más bajo y un umbral de excitación elevado predicen una terapia exitosa.
Se están haciendo estudios de los resultados cardiovasculares con la estimulación del nervio hipogloso. Se observó que la variabilidad de la frecuencia cardíaca durante el sueño mejoró (disminuyó), lo que se correlacionó con la mejoría del IAH. En un estudio de la Clínica Cleveland, la presión positiva en las vías respiratorias redujo las presiones arteriales diastólica y media, más que la estimulación del nervio hipogloso.
En otro estudio se observó que, aunque con la estimulación del nervio hipogloso la presión arterial diastólica disminuyó 3,7 mm Hg y la presión arterial media disminuyó 3,7 mm Hg, esta mejoría puede estar presente solo en el subgrupo de pacientes con hipertensión arterial inicial.
> Avance maxilomandibular
La cirugía esquelética para el avance maxilomandibular puede aumentar el volumen de las vías respiratorias. La combinación de una osteotomía de LeFort 1 con una división sagital bilateral de las ramas mandibulares crea una "caja" más grande para dar más espacio alrededor del tejido blando contenido en la vía aérea.
En 9 series de casos de 234 pacientes esta cirugía se asoció con una reducción del 87% de IAH. Sin embargo, un estudio de Kezirian et al halló que se realizaron 30 veces más uvulopalatofaringoplastiasse en comparación con el avance maxilomandibular, lo que sugiere que a pesar de la excelente tasa de éxito de esta última, los pacientes aceptan menos el procedimiento.
1. Morrone E, Giordano A, Carli S, et al. Something is changing in adherence to CPAP therapy: real world data after 1 year of treatment in patients with obstructive sleep apnoea. Eur Respir J 2020; 55(3):1901419. doi:10.1183/13993003.01419-2019
2. Eckert DJ, White DP, Jordan AS, Malhotra A, Wellman A. Defi ning phenotypic causes of obstructive sleep apnea. Identifi cation of novel therapeutic targets. Am J Respir Crit Care Med 2013; 188(8):996– 1004. doi:10.1164/rccm.201303-0448OC
3. Zinchuk A, Yaggi HK. Phenotypic subtypes of OSA: a challenge and opportunity for precision medicine. Chest 2020; 157(2):403–420. doi:10.1016/j.chest.2019.09.002
4. American Academy of Sleep Medicine. International Classifi cation of Sleep Disorders. 3rd ed. Darien, IL: American Academy of Sleep Medicine; 2014.
5. Peppard PE, Young T, Barnet JH, Palta M, Hagen EW, Hla KM. Increased prevalence of sleep-disordered breathing in adults. Am J Epidemiol 2013; 177(9):1006–1014. doi:10.1093/aje/kws342
6. Bonsignore MR, Pepin JL, Cibella F, et al. Excessive daytime sleepiness in obstructive sleep apnea patients treated with continuous positive airway pressure: data from the European Sleep Apnea Database. Front Neurol 2021; 12:690008. doi:10.3389/fneur.2021.690008
7. Pocobelli G, Akosile MA, Hansen RN, et al. Obstructive sleep apnea and risk of motor vehicle accident. Sleep Med 2021; 85:196–203. doi:10.1016/j.sleep.2021.07.019
8. Cai A, Wang L, Zhou Y. Hypertension and obstructive sleep apnea. Hypertens Res 2016; 39(6):391–395. doi:10.1038/hr.2016.11
9. Kendzerska T, Gershon AS, Hawker G, Tomlinson G, Leung RS. Obstructive sleep apnea and incident diabetes. A historical cohort study. Am J Respir Crit Care Med 2014; 190(2):218–225.doi:10.1164/rccm.201312-2209OC Downloaded
10. Marin JM, Carrizo SJ, Vicente E, Agusti AG. Long-term cardiovascular outcomes in men with obstructive sleep apnoea-hypopnoea with or without treatment with continuous positive airway pressure: an observational study. Lancet 2005; 365(9464):1046–1053.doi:10.1016/S0140-6736(05)71141-7
11. Lal C, Ayappa I, Ayas N, et al. The link between obstructive sleep apnea and neurocognitive impairment: an offi cial American Thoracic Society Workshop report. Ann Am Thorac Soc 2022; 19(8):1245–1256. doi:10.1513/AnnalsATS.202205-380ST
12. Patel A, Chong DJ. Obstructive sleep apnea: cognitive outcomes. Clin Geriatr Med 2021; 37(3):457–467. doi:10.1016/j.cger.2021.04.007
13. Cartwright RD. Effect of sleep position on sleep apnea severity. Sleep 1984; 7(2):110–114. doi:10.1093/sleep/7.2.110
14. Srijithesh PR, Aghoram R, Goel A, Dhanya J. Positional therapy for obstructive sleep apnoea. Cochrane Database Syst Rev 2019; 5(5):CD010990. doi:10.1002/14651858.CD010990.pub2
15. Randerath W, Verbraecken J, de Raaff CAL, et al. European Respiratory Society guideline on non-CPAP therapies for obstructive sleep apnoea. Eur Respir Rev 2021; 30(162):210200.doi:10.1183/16000617.0200-2021
16. Taranto-Montemurro L, Messineo L, Azarbarzin A, et al. Effects of the combination of atomoxetine and oxybutynin on OSA endotypic traits. Chest 2020; 157(6):1626–1636.doi:10.1016/j.chest.2020.01.012
17. Mehta V, Vasu TS, Phillips B, Chung F. Obstructive sleep apnea and oxygen therapy: a systematic review of the literature and meta-analysis. J Clin Sleep Med 2013; 9(3):271–279. doi:10.5664/jcsm.2500
18. Sands SA, Edwards BA, Terrill PI, et al. Identifying obstructive sleep apnoea patients responsive to supplemental oxygen therapy. Eur Respir J 2018; 52(3):1800674. doi:10.1183/13993003.00674-2018
19. Vecchierini MF, Attali V, Collet JM, et al. Mandibular advancement device use in obstructive sleep apnea: ORCADES study 5-year follow- up data. J Clin Sleep Med 2021; 17(8):1695–1705. doi:10.5664/jcsm.9308
20. Camacho M, Certal V, Abdullatif J, et al. Myofunctional therapy to treat obstructive sleep apnea: a systematic review and meta-analysis. Sleep 2015; 38(5):669–675. doi:10.5665/sleep.4652
21. Joosten SA, Tan M, Wong AM, et al. A randomized controlled trial of oxygen therapy for patients who do not respond to Upper airway surgery for obstructive sleep apnea. J Clin Sleep Med 2021; 17(3):445–452. doi:10.5664/jcsm.8920
22. Chen H, Eckert DJ, van der Stelt PF, et al. Phenotypes of responders to mandibular advancement device therapy in obstructive sleep apnea patients: a systematic review and meta-analysis. Sleep Med Rev 2020; 49:101229. doi:10.1016/j.smrv.2019.101229
23. Prasad KT, Sehgal IS, Agarwal R, Nath Aggarwal A, Behera D, Dhooria S. Assessing the likelihood of obstructive sleep apnea: a comparison of nine screening questionnaires. Sleep Breath 2017; 21(4):909–917. doi:10.1007/s11325-017-1495-4
24. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000; 284(23):3015–3021. doi:10.1001/jama.284.23.3015
25. Schwartz AR, Gold AR, Schubert N, et al. Effect of weight loss on upper airway collapsibility in obstructive sleep apnea. Am Rev Respir Dis 1991; 144(3 Pt 1):494–498. doi:10.1164/ajrccm/144.3_Pt_1.494
26. Kuna ST, Reboussin DM, Strotmeyer ES, et al. Effects of weight los on obstructive sleep apnea severity. Ten-year results of the sleep AHEAD study. Am J Respir Crit Care Med 2021; 203(2):221–229. doi:10.1164/rccm.201912-2511OC
27. Buchwald H, Avidor Y, Braunwald E, et al. Bariatric surgery: a systematic review and meta-analysis [published correction appears in JAMA 2005; 293(14):1728]. JAMA 2004; 292(14):1724–1737. doi:10.1001/jama.292.14.1724
28. Nastałek P, Polok K, Celejewska-Wojcik N, et al. Impact of bariatric surgery on obstructive sleep apnea severity and continuous positive airway pressure therapy compliance—prospective observational study. Sci Rep 2021; 11(1):5003. doi:10.1038/s41598-021-84570-6
29. Peromaa-Haavisto P, Tuomilehto H, Kossi J, et al. Obstructive sleep apnea: the effect of bariatric surgery after 12 months. A prospective multicenter trial. Sleep Med 2017; 35:85–90. doi:10.1016/j.sleep.2016.12.017
30. Dixon JB, Schachter LM, O’Brien PE, et al. Surgical vs conventional therapy for weight loss treatment of obstructive sleep apnea: a randomized controlled trial. JAMA 2012; 308(11):1142–1149. doi:10.1001/2012.jama.11580
31. Blackman A, Foster GD, Zammit G, et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE sleep apnea randomized clinical trial. Int J Obes (Lond) 2016; 40(8):1310–1319. doi:10.1038/ijo.2016.52
32. Sultana R, Sissoho F, Kaushik VP, Raji MA. The case for early use of glucagon-like peptide-1 receptor agonists in obstructive sleep apnea patients with comorbid diabetes and metabolic syndrome. Life (Basel) 2022; 12(8):1222. doi:10.3390/life12081222
33. Ard J, Fitch A, Fruh S, Herman L. Weight loss and maintenance related to the mechanism of action of glucagon-like peptide 1 receptor agonists. Adv Ther 2021; 38(6):2821–2839. doi:10.1007/s12325-021-01710-0
34. Iftikhar IH, Kline CE, Youngstedt SD. Effects of exercise training on sleep apnea: a meta-analysis. Lung 2014; 192(1):175–184. doi:10.1007/s00408-013-9511-3
35. Kline CE, Reboussin DM, Foster GD, et al. The effect of changes in cardiorespiratory fi tness and weight on obstructive sleep apnea severity in overweight adults with type 2 diabetes. Sleep 2016; 39(2):317–325. doi:10.5665/sleep.5436
36. Ozeke O, Erturk O, Gungor M, et al. Infl uence of the right- versus left-sided sleeping position on the apnea-hypopnea index in patients with sleep apnea. Sleep Breath 2012; 16(3):617–620. doi:10.1007/s11325-011-0547-4
37. Pevernagie DA, Stanson AW, Sheedy PF 2nd, Daniels BK, Shepard JW Jr. Effects of body position on the upper airway of patients with obstructive sleep apnea. Am J Respir Crit Care Med 1995; 152(1):179–185. doi:10.1164/ajrccm.152.1.7599821
38. Simou E, Britton J, Leonardi-Bee J. Alcohol and the risk of sleep apnoea: a systematic review and meta-analysis. Sleep Med 2018; 42:38–46. doi:10.1016/j.sleep.2017.12.005
39. Kolla BP, Foroughi M, Saeidifard F, Chakravorty S, Wang Z, Mansukhani MP. The impact of alcohol on breathing parameters during sleep: a systematic review and meta-analysis. Sleep Med Rev 2018; 42:59–67. doi:10.1016/j.smrv.2018.05.007
40. Burgos-Sanchez C, Jones NN, villion M, et al. Impact of alcohol consumption on snoring and sleep apnea: a systematic review and meta-analysis. Otolaryngol Head Neck Surg 2020; 163(6):1078–1086. doi:10.1177/0194599820931087
41. Krol RC, Knuth SL, Bartlett D Jr. Selective reduction of genioglossal muscle activity by alcohol in normal human subjects. Am Rev Respir Dis 1984; 129(2):247–250. pmid:6421210
42. St John WM, Bartlett D Jr, Knuth KV, Knuth SL, Daubenspeck JA. Differential depression of hypoglossal nerve activity by alcohol. Protection by pretreatment with medroxyprogesterone acetate. Am Rev Respir Dis 1986; 133(1):46–48. doi:10.1164/arrd.1986.133.1.46
43. Mason M, Welsh EJ, Smith I. Drug therapy for obstructive sleep apnoea in adults. Cochrane Database Syst Rev 2013;(5):CD003002. doi:10.1002/14651858.CD003002.pub3
44. Brownell LG, West P, Sweatman P, Acres JC, Kryger MH. Protriptyline in obstructive sleep apnea: a double-blind trial. N Engl J Med 1982; 307(17):1037–1042.
doi:10.1056/NEJM198210213071701
45. Hanzel DA, Proia NG, Hudgel DW. Response of obstructive sleep apnea to fl uoxetine and protriptyline. Chest 1991; 100(2):416–421. doi:10.1378/chest.100.2.416
46. Eskandari D, Zou D, Grote L, Hoff E, Hedner J. Acetazolamide reduces blood pressure and sleep-disordered breathing in patients with hypertension and obstructive sleep apnea: a randomized controlled trial. J Clin Sleep Med 2018; 14(3):309–317. doi:10.5664/jcsm.6968
47. Edwards BA, Sands SA, Eckert DJ, et al. Acetazolamide improves loop gain but not the other physiological traits causing obstructive sleep apnoea. J Physiol 2012; 590(5):1199–1211. doi:10.1113/jphysiol.2011.223925
48. Taranto-Montemurro L, Messineo L, Sands SA, et al. The combination of atomoxetine and oxybutynin greatly reduces obstructive sleep apnea severity. a randomized, placebo-controlled, double-blind crossover trial. Am J Respir Crit Care Med 2019; 199(10):1267–1276. doi:10.1164/rccm.201808-1493OC
49. Perger E, Taranto-Montemurro L, Rosa D, et al. Reboxetine plus oxybutynin for OSA treatment: a 1-week, randomized, placebo-controlled, double-blind crossover trial. Chest 2022; 161(1):237–247. doi:10.1016/j.chest.2021.08.080
50. Messineo L, Taranto-Montemurro L, Calianese N, et al. Atomoxetine and fesoterodine combination improves obstructive sleep apnoea severity in patients with milder upper airway collapsibility. Respirology 2022; 27(11):975–982. doi:10.1111/resp.14326
51. Gottlieb DJ, Punjabi NM, Mehra R, et al. CPAP versus oxygen in obstructive sleep apnea. N Engl J Med 2014; 370(24):2276–2285. doi:10.1056/NEJMoa1306766
52. Chan AS, Sutherland K, Schwab RJ, et al. The effect of mandibular advancement on upper airway structure in obstructive sleep apnoea. Thorax 2010; 65(8):726–732. doi:10.1136/thx.2009.131094
53. Trzepizur W, Cistulli PA, Glos M, et al. Health outcomes of continuous positive airway pressure versus mandibular advancement device for the treatment of severe obstructive sleep apnea: an individual participant data meta-analysis. Sleep 2021; 44(7):zsab015. doi:10.1093/sleep/zsab015
54. Levine M, Cantwell MK, Postol K, Schwartz DB. Dental sleep medicine standards for screening, treatment, and management of sleep-related breathing disorders in adults using oral appliance therapy: an update. J Dent Sleep Med 2022; 9(4):1–13. doi:10.15331/jdsm.7266
55. Sutherland K, Phillips CL, Davies A, et al. CPAP pressure for prediction of oral appliance treatment response in obstructive sleep apnea. J Clin Sleep Med 2014; 10(9):943–949. doi:10.5664/jcsm.4020
56. de Vries GE, Wijkstra PJ, Houwerzijl EJ, Kerstjens HAM, Hoekema A. Cardiovascular effects of oral appliance therapy in obstructive sleep apnea: a systematic review and meta-analysis. Sleep Med Rev 2018; 40:55–68. doi:10.1016/j.smrv.2017.10.004
57. Rietz H, Franklin KA, Carlberg B, Sahlin C, Marklund M. Nocturnal blood pressure is reduced by a mandibular advancement device for sleep apnea in women: fi ndings from secondary analyses of a randomized trial. J Am Heart Assoc 2018; 7(13):e008642. doi:10.1161/JAHA.118.008642
58. Gotsopoulos H, Kelly JJ, Cistulli PA. Oral appliance therapy reduces blood pressure in obstructive sleep apnea: a randomized, controlled trial. Sleep 2004; 27(5):934–941. doi:10.1093/sleep/27.5.934
59. Tegelberg A, Wilhelmsson B, Erixon-Lindroth N, Lindstrom LH. Improved cognitive functions after treatment with an oral appliance in obstructive sleep apnea. Nat Sci Sleep 2012; 4:89–96. doi:10.2147/NSS.S33849
60. Baptista PM, Martinez Ruiz de Apodaca P, Carrasco M, et al. Daytime neuromuscular electrical therapy of tongue muscles in improving snoring in individuals with primary snoring and mild obstructive sleep apnea. J Clin Med 2021; 10(9):1883. doi:10.3390/jcm10091883
61. Nokes B, Baptista PM, de Apodaca PMR, et al. Transoral awake state neuromuscular electrical stimulation therapy for mild obstructive sleep apnea. Sleep Breath 2023; 27(2):527–534. doi:10.1007/s11325-022-02644-9
62. Lin HY, Chang CJ, Chiang CC, Su PL, Lin CY, Hung CH. Effects of a comprehensive physical therapy on moderate and severe obstructive sleep apnea—a preliminary randomized controlled trial. J Formos Med Assoc 2020; 119(12):1781–1790. doi:10.1016/j.jfma.2020.01.011
63. Ieto V, Kayamori F, Montes MI, et al. Effects of oropharyngeal exercises on snoring: a randomized trial. Chest 2015; 148(3):683–691. doi:10.1378/chest.14-2953
64. Puhan MA, Suarez A, Lo Cascio C, Zahn A, Heitz M, Braendli O. Didgeridoo playing as alternative treatment for obstructive sleep apnoea syndrome: randomised controlled trial. BMJ 2006; 332(7536):266–270. doi:10.1136/bmj.38705.470590.55
65. van der Weijden FN, Lobbezoo F, Slot DE. The effect of playing a wind instrument or singing on risk of sleep apnea: a systematic review and meta-analysis. J Clin Sleep Med 2020; 16(9):1591–1601. doi:10.5664/jcsm.8628
66. Patil SP, Schneider H, Marx JJ, Gladmon E, Schwartz AR, Smith PL. Neuromechanical control of upper airway patency during sleep. J Appl Physiol (1985) 2007; 102(2):547–556. doi:10.1152/japplphysiol.00282.2006
67. Randerath WJ, Galetke W, Domanski U, Weitkunat R, Ruhle KH. Tongue-muscle training by intraoral electrical neurostimulation in patients with obstructive sleep apnea. Sleep 2004; 27(2):254–259. doi:10.1093/sleep/27.2.254
68. Diaferia G, Santos-Silva R, Truksinas E, et al. Myofunctional therapy improves adherence to continuous positive airway pressure treatment. Sleep Breath 2017; 21(2):387–395. doi:10.1007/s11325-016-1429-6
69. Neumannova K, Hobzova M, Sova M, Prasko J. Pulmonary rehabilitation and oropharyngeal exercises as an adjunct therapy in obstructive sleep apnea: a randomized controlled trial. Sleep Med 2018; 52:92–97. doi:10.1016/j.sleep.2018.03.022
70. Kryger MH, Berry RB, Massie CA. Long-term use of a nasal expiratory positive airway pressure (EPAP) device as a treatment for obstructive sleep apnea (OSA). J Clin Sleep Med 2011; 7(5):449–453B. doi:10.5664/JCSM.1304
71. Nigam G, Pathak C, Riaz M. Effectiveness of oral pressure therapy in obstructive sleep apnea: a systematic analysis. Sleep Breath 2016; 20(2):663–671. doi:10.1007/s11325-015-1270-3
72. Kram JA, Woidtke RV, Klein KB, Rose RM. Evaluation of continuous negative external pressure (cNEP) for the treatment of obstructive sleep apnea: a pilot study. J Clin Sleep Med 2017; 13(8):1009–1012. doi:10.5664/jcsm.6710
73. Boyd SB, Upender R, Walters AS, et al. Effective apnea-hypopnea index (“effective AHI”): a new measure of effectiveness for positive airway pressure therapy. Sleep 2016; 39(11):1961–1972. doi:10.5665/sleep.6224
74. Walsh JK, Griffi n KS, Forst EH, et al. A convenient expiratory positive airway pressure nasal device for the treatment of sleep apnea in patients non-adherent with continuous positive airway pressure. Sleep Med 2011; 12(2):147–152. doi:10.1016/j.sleep.2010.06.011
75. Berry RB, Kryger MH, Massie CA. A novel nasal expiratory positive airway pressure (EPAP) device for the treatment of obstructive sleep apnea: a randomized controlled trial. Sleep 2011; 34(4):479–485. doi:10.1093/sleep/34.4.479
76. Gambino F, Zammuto MM, Virzi A, Conti G, Bonsignore MR. Treatment options in obstructive sleep apnea. Intern Emerg Med 2022; 17(4):971–978. doi:10.1007/s11739-022-02983-1
77. McEvoy RD, Antic NA, Heeley E, et al. CPAP for prevention of cardiovascular events in obstructive sleep apnea. N Engl J Med 2016; 375(10):919–931. doi:10.1056/NEJMoa1606599
78. Banghoj AM, Krogager C, Kristensen PL, et al. Effect of 12-week continuous positive airway pressure therapy on glucose levels assessed by continuous glucose monitoring in people with type 2 diabetes and obstructive sleep apnoea; a randomized controlled trial. Endocrinol Diabetes Metab 2020; 4(2):e00148. doi:10.1002/edm2.148
79. Patil SP, Ayappa IA, Caples SM, Kimoff RJ, Patel SR, Harrod CG. Treatment of adult obstructive sleep apnea with positive airway pressure: an American Academy of Sleep Medicine systematic review, meta-analysis, and GRADE assessment. J Clin Sleep Med 2019; 15(2):301–334. doi:10.5664/jcsm.7638
80. Walia HK, Griffi th SD, Foldvary-Schaefer N, et al. Longitudinal effect of CPAP on BP in resistant and nonresistant hypertension in a large clinic-based cohort. Chest 2016; 149(3):747–755. doi:10.1378/chest.15-0697
81. Wang ML, Wang C, Tuo M, et al. Cognitive effects of treating obstructive sleep apnea: a meta-analysis of randomized controlled trials. J Alzheimers Dis 2020; 75(3):705–715. doi:10.3233/JAD-200088
82. Kushida CA, Nichols DA, Holmes TH, et al. Effects of continuous ositive airway pressure on neurocognitive function in obstructive sleep apnea patients: the Apnea Positive Pressure Long-term Effi - cacy Study (APPLES) [published correction appears in Sleep 2016; 39(7):1483]. Sleep 2012; 35(12):1593–1602. doi:10.5665/sleep.2226
83. Wimms AJ, Kelly JL, Turnbull CD, et al. Continuous positive airway pressure versus standard care for the treatment of people with mild obstructive sleep apnoea (MERGE): a multicentre, randomised controlled trial. Lancet Respir Med 2020; 8(4):349–358. doi:10.1016/S2213-2600(19)30402-3
84. Cistulli PA, Armitstead J, Pepin JL, et al. Short-term CPAP adherence in obstructive sleep apnea: a big data analysis using real world data. Sleep Med 2019; 59:114–116. doi:10.1016/j.sleep.2019.01.004
85. Brown LK. Up, down, or no change: weight gain as an unwanted side effect of CPAP for obstructive sleep apnea. J Clin Sleep Med 2020; 16(S1):21–22. doi:10.5664/jcsm.8888
86. Drager LF, Brunoni AR, Jenner R, Lorenzi-Filho G, Bensenor IM, Lotufo PA. Effects of CPAP on body weight in patients with obstructive sleep apnoea: a meta-analysis of randomised trials. Thorax 2015; 70(3):258–264.
doi:10.1136/thoraxjnl-2014-205361
87. Quan SF, Budhiraja R, Clarke DP, et al. Impact of treatment with continuous positive airway pressure (CPAP) on weight in obstructive sleep apnea. J Clin Sleep Med 2013; 9(10):989–993. doi:10.5664/jcsm.3064
88. Shechter A. Effects of continuous positive airway pressure on energy balance regulation: a systematic review. Eur Respir J 2016; 48(6):1640–1657. doi:10.1183/13993003.00689-2016
89. Tachikawa R, Ikeda K, Minami T, et al. Changes in energy metabolism after continuous positive airway pressure for obstructive sleep apnea. Am J Respir Crit Care Med 2016; 194(6):729–738. doi:10.1164/rccm.201511-2314OC
90. Patil SP, Ayappa IA, Caples SM, Kimoff RJ, Patel SR, Harrod CG. Treatment of adult obstructive sleep apnea with positive airway pressure: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2019; 15(2):335–343. doi:10.5664/jcsm.7640
91. Sleeper G, Rashidi M, Strohl KP, et al. Comparison of expiratory pressures generated by four different EPAP devices in a laboratory bench setting. Sleep Med 2022; 96:87–92. doi:10.1016/j.sleep.2022.05.004
92. Mahadevia AK, Onal E, Lopata M. Effects of expiratory positive airway pressure on sleep-induced respiratory abnormalities in patients with hypersomnia-sleep apnea syndrome. Am Rev Respir Dis 1983; 128(4):708–711. doi:10.1164/arrd.1983.128.4.708
93. Hakim TS, Bonnetti M, Bosco G, Camporesi EM. EPAP devices Optipillows, Bongo Rx, and Theravent: fl ow resistance and the pressures they generate. J Sleep Med Disord 2021; 7(1):1119.
94. Patel AV, Hwang D, Masdeu MJ, Chen GM, Rapoport DM, Ayappa I. Predictors of response to a nasal expiratory resistor device and its potential mechanisms of action for treatment of obstructive sleep apnea. J Clin Sleep Med 2011; 7(1):13–22. pmid:21344051
95. Rossi VA, Winter B, Rahman NM, et al. The effects of Provent on moderate to severe obstructive sleep apnoea during continuous positive airway pressure therapy withdrawal: a randomised controlled trial. Thorax 2013; 68(9):854–859. doi:10.1136/thoraxjnl-2013-203508
96. Schwab RJ, Kim C, Siegel L, et al. Examining the mechanism of action of a new device using oral pressure therapy for the treatment of obstructive sleep apnea. Sleep 2014; 37(7):1237–1247. doi:10.5665/sleep.3846
97. Hung TC, Liu TJ, Lu TM, et al. Building a model to precisely target the responders of a novel intermittent negative air pressure device- with mechanism defi nition. Sleep Med 2020; 72:20–27. doi:10.1016/j.sleep.2020.03.014
98. Kram JA, Pelayo R. Variable negative external pressure—an alternative to continuous positive airway pressure for the treatment of obstructive sleep apnea: a pilot study. J Clin Sleep Med 2022; 18(1):305–314. doi:10.5664/jcsm.9680
99. Caples SM, Rowley JA, Prinsell JR, et al. Surgical modifi cations of the upper airway for obstructive sleep apnea in adults: a systematic review and meta-analysis. Sleep 2010; 33(10):1396–1407. doi:10.1093/sleep/33.10.1396
100. Strollo PJ Jr, Soose RJ, Maurer JT, et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med 2014; 370(2):139–149. doi:10.1056/NEJMoa1308659
101. Bellamkonda N, Shiba T, Mendelsohn AH. Adverse events in hypoglossal nerve stimulator implantation: 5-year analysis of the FDA MAUDE database. Otolaryngol Head Neck Surg 2021; 164(2):443–447. doi:10.1177/0194599820960069
102. US Food and Drug Administration. Inspire upper airway stimulation. Updated July 13, 2023. https://www.fda.gov/medical-devices/ recently-approved-devices/inspire-upper-airway-stimulation-p130008s090. Accessed November 6, 2023.
103. Fujita S. UPPP for sleep apnea and snoring. Ear Nose Throat J 1984; 63(5):227–235. pmid:6734482
104. Sundman J, Browaldh N, Fehrm J, Friberg D. Eight-year follow-up of modifi ed uvulopalatopharyngoplasty in patients with obstructive sleep apnea. Laryngoscope 2021; 131(1):E307–E313. doi:10.1002/lary.28960
105. Friedman M, Ibrahim H, Lee G, Joseph NJ. Combined uvulopalatopharyngoplasty and radiofrequency tongue base reduction for treatment of obstructive sleep apnea/hypopnea syndrome. Otolaryngol Head Neck Surg 2003; 129(6):611–621. doi:10.1016/j.otohns.2003.07.004
106. Mashaqi S, Patel SI, Combs D, et al. The hypoglossal nerve stimulation as a novel therapy for treating obstructive sleep apnea—a literatura review. Int J Environ Res Public Health 2021; 18(4):1642. doi:10.3390/ijerph18041642\
107. Pascoe M, Wang L, Aylor J, et al. Association of hypoglossal nerve stimulation with improvements in long-term, patient-reported outcomes and comparison with positive airway pressure for patients with obstructive sleep apnea. JAMA Otolaryngol Head Neck Surg 2022; 148(1):61–69. doi:10.1001/jamaoto.2021.2245
108. Thaler E, Schwab R, Maurer J, et al. Results of the ADHERE upper airway stimulation registry and predictors of therapy effi cacy. Laryngoscope 2020; 130(5):1333–1338. doi:10.1002/lary.28286
109. Woodson BT, Strohl KP, Soose RJ, et al. Upper airway stimulation for obstructive sleep apnea: 5-year outcomes. Otolaryngol Head Neck Surg 2018; 159(1):194–202. doi:10.1177/0194599818762383
110. Chao TN, Thaler ER. Predictors of success in hypoglossal nerve stimulator implantation for obstructive sleep apnea. World J Otorhinolaryngol Head Neck Surg 2020; 7(1):40–44. doi:10.1016/j.wjorl.2020.02.007
111. Op de Beeck S, Wellman A, Dieltjens M, et al. Endotypic mechanisms of successful hypoglossal nerve stimulation for obstructive sleep apnea. Am J Respir Crit Care Med 2021; 203(6):746–755. doi:10.1164/rccm.202006-2176OC
112. Dedhia RC, Quyyumi AA, Park J, Shah AJ, Strollo PJ, Bliwise DL. Cardiovascular endpoints for obstructive sleep apnea with twelfth cranial nerve stimulation (CARDIOSA-12): rationale and methods. Laryngoscope 2018; 128(11):2635–2643. doi:10.1002/lary.27284
113. Dedhia RC, Shah AJ, Bliwise DL, et al. Hypoglossal nerve stimulation and heart rate variability: analysis of STAR trial responders. Otolaryngol Head Neck Surg 2019; 160(1):165–171. doi:10.1177/0194599818800284
114. Walia HK, Thompson NR, Strohl KP, et al. Upper airway stimulation vs positive airway pressure impact on BP and sleepiness symptoms in OSA. Chest 2020; 157(1):173–183. doi:10.1016/j.chest.2019.06.020
115. McKinlay AJ, Walters BK, Aden JK, Scalzitti NJ. Upper airway stimulation therapy effect on blood pressure. Otolaryngol Head Neck Surg 2023; 168(6):1551–1556. doi:10.1002/ohn.210
116. Kezirian EJ, Maselli J, Vittinghoff E, Goldberg AN, Auerbach AD. Obstructive sleep apnea surgery practice patterns in the United States: 2000 to 2006. Otolaryngol Head Neck Surg 2010; 143(3):441–447. doi:10.1016/j.otohns.2010.05.009