Perfil microbiano de las manchas negras en la dentición primaria
Ene 24 de 2025 0
Introducción
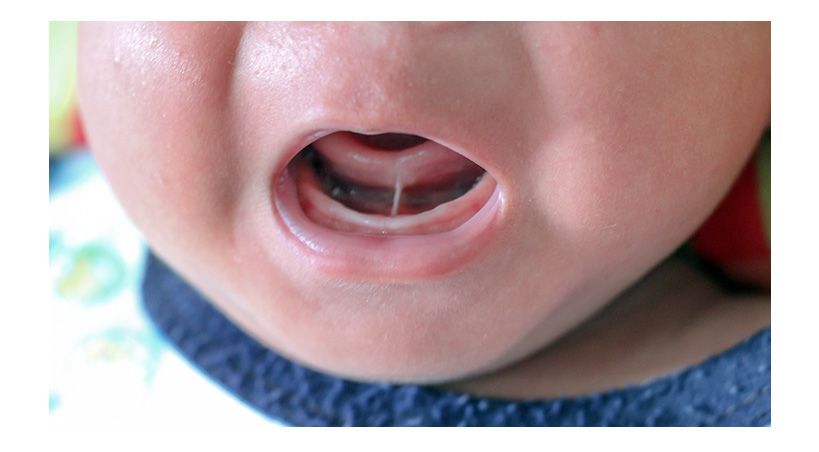
Las manchas negras extrínsecas del diente (EBS por su sigla en inglés) se encuentra comúnmente en la dentición primaria. Las principales características clínicas son los puntos negros discontinuos o líneas oscuras depositadas en la corona, que pueden cubrir la mayor parte de la superficie del diente o incluso afectar las fosas y surcos en casos graves.
La prevalencia de EBS varía de 2,4% a 26%. Estas manchas negras se adhieren firmemente a la superficie del diente, y no se pueden eliminar con métodos de autocuidado de la salud bucal diarios, como el cepillado de dientes.
Actualmente, las EBS se eliminan principalmente a través de raspado y desbridamiento profesional. Sin embargo, a menudo se reforman rápidamente, sin una solución fundamental. Las EBS comprometen significativamente la apariencia y la confianza de los niños y causa problemas a largo plazo para los pacientes y sus familias.
Actualmente, no hay consenso sobre la etiología de las EBS. La asociación entre EBS y las características microbianas orales relacionadas es una línea de investigación. El desarrollo de la biotecnología molecular ha mejorado la comprensión del entorno microecológico de las EBS, ya que se especula que los cambios en ciertos microorganismos orales pueden conducir a la formación de EBS.
Biotécnicas molecularesTecnología de secuenciación de próxima generación (SPG). Esta tecnología se originó a partir de la tecnología de secuenciación de Sanger. La SPG es una tecnología de secuenciación de ADN basada en PCR y chips genéticos, que puede determinar simultáneamente la secuencia de cientos de miles a millones de moléculas de ADN. Debido al alto rendimiento y la corta longitud de lectura de la SPG, la secuenciación de amplicones utiliza las regiones variables de los microorganismos, como 16S, 18S e ITS para obtener la estructura de la comunidad microbiana, la relación evolutiva y la correlación entre los microbiomas y su entorno ecológico. A diferencia de la secuenciación de Sanger, la tecnología SPG no depende de microorganismos cultivables. También se pueden detectar algunos microorganismos muertos e incultivables. Tiene ventajas significativas en el procesamiento de muestras a gran escala, mejorando la velocidad de secuenciación, aumentando el rendimiento de la secuenciación y reduciendo el costo y el tiempo de identificación microbiana. La SPG puede leer hasta 250e800 pb, por lo que no se pudo completar la longitud de la secuencia del gen ARNr 16S bacteriano (1540 pb). Por lo tanto, los microbiomas asociados solo se pueden identificar a nivel de género, no exactamente a nivel de especie. En cuanto a la relación entre microorganismos y enfermedades, es más valioso definir la especie o incluso la cepa. Por lo tanto, la adopción de la tecnología de secuenciación de tercera generación para obtener secuencias de lectura más largas ayudará a obtener una información microbiana más concisa y una clasificación para estudios posteriores del mecanismo de patogénesis.
Proteómica. Los proteomas son todas las proteínas que produce una célula o tejido en un tiempo o período de vida determinado. La proteómica es un método de investigación que se utiliza para separar las proteínas mixtas complejas en proteínas individuales mediante electroforesis en gel bidimensional o cromatografía líquida multidimensional. La tripsina digiere las proteínas individuales en péptidos, que se comparan con la base de datos de espectrometría de masas de huellas dactilares proteómicas microbianas estándar para la identificación y clasificación microbianas. En comparación con las tecnologías de secuenciación, las proteínas tienen más estabilidad que los genes, el proceso de extracción las afecta menos y pueden reflejar mejor las funciones biológicas dinámicas expresadas in situ. Por lo tanto, la proteómica es un método de investigación prometedor en el futuro.
Características morfológicasBajo el microscopio confocal, la biopelícula de placa supragingival madura se compone principalmente de bacilos y cocos aeróbicos gram positivos o anaeróbicos facultativos, que se agregan en una estructura de "erizo". El marco contiene una base compuesta por filamentos de Corynebacterium, un anillo con bacilos y bacterias filamentosas y una periferia de estructuras de mazorca de maíz que consisten en cocos.
Los principales componentes bacterianos de las EBS también incluyen bacilos aerobios gram positivos o anaerobios facultativos y cocos.
Existe una membrana basal sin células y desestructurada similar a las membranas adquiridas en las que las bacterias en forma de bastón se agregan verticalmente y se adhieren firmemente entre sí, careciendo de una matriz intercelular y formando una estructura densa de "red".
En áreas con menos adhesión de bacilos, los depósitos de calcio amorfo están cubiertos por una gran cantidad de cocos, que se consideran un tipo especial de placa dental.
Características fisicoquímicasInvestigadores anteriores han propuesto que las EBS son un tipo de placa dental especial que contiene organismos y compuestos inorgánicos insolubles, como plasma férrico, de calcio y fósforo. Varios estudios hallaron que el hierro y la microbiota estaban estrechamente relacionados con las EBS. En 2017, Zhang y col. analizaron las muestras de EBS mediante espectrometría de masas de plasma acoplado inductivamente, y observaron que la concentración de hierro en las EBS era significativamente mayor que en la placa normal, lo que sugiere que el hierro podría estar relacionado con las EBS.
En 2022, utilizaron el software de investigación filogenética de comunidades mediante la reconstrucción de estados no observados (PICRUSt) para determinar los perfiles de función microbiana. Encontraron que la proteína receptora de membrana externa del complejo de hierro, el sistema de transporte del complejo de hierro y el sistema de transporte de hierro (III) (KO2010, KO2011, KO2012) se enriquecieron en las muestras de placa EBS.
Las actividades de estos sistemas mejoraron significativamente. De hecho, las bacterias no podían producir hierro, pero secretaron el sideróforo. El sideróforo queló los iones de hierro del entorno, y estos iones se unieron a las proteínas receptoras de hierro de la membrana externa en las bacterias debido a enzimas.
Posteriormente, el hierro se importó a la célula y comenzó una mayor utilización biológica. Por lo tanto, el enriquecimiento y la actividad mejorada de las proteínas receptoras de membrana externa del complejo de hierro y las proteínas relacionadas con los sistemas de transporte de hierro sugirieron una mayor biodisponibilidad de hierro en las EBS.
El hierro podría afectar la formación de biopelículas, el metabolismo bacteriano y el crecimiento y la reproducción de EBS. También propusieron que las EBS podrían ser los compuestos de hierro que produce el metabolismo microbiano.
Reid y col. observaron regiones azules en las muestras de EBS con una lupa de mano, sugiriendo la presencia de sulfuro. En combinación con los resultados de los estudios espectrofotométricos, se especuló que podría ser sulfuro férrico.
Se supuso que las bacterias de H2S producidas reaccionaban con el hierro en la saliva o el líquido crevicular gingival y formaban sulfuro férrico. Por lo tanto, la formación de EBS podría ser el producto de la interacción entre los metabolitos microbianos y el ambiente ecológico. Además, los investigadores separaron el Bacteroides melaninogenicus de las muestras de EBS, que es un tipo de bacteria cromogénica. Puede producir sustancias negras, como sulfuro ferroso coloidal extracelular, melanina extracelular, hemoglobina intracelular y derivados intracelulares de la hemoglobina, lo que sugiere que las bacterias también podrían producir directamente EBS.
Hipótesis de etiología microbianaCon el surgimiento de la tecnología SPG, se descubrió un entorno microecológico especial en las EBS, donde también se detectaron otras bacterias patógenas sospechosas. Los autores categorizaron estos hallazgos en una hipótesis de placa específica y una hipótesis de microbioma central, respectivamente.
Hipótesis de placa específica. En 1931, Bibby y col. cultivaron muestras de EBS en entornos aeróbicos y anaeróbicos, y hallaron 7 bacterias filamentosas que se consideraron las bacterias patógenas de EBS. Sin embargo, esta microbiota no se identificó debido a limitaciones técnicas. En 1974, Slots y col. cultivaron bacterias en muestras de EBS. También realizaron pruebas bioquímicas y observaciones de morfología celular. Hallaron que las bacterias Gram-positivas representaban aproximadamente el 90% de los microorganismos cultivables en EBS, de los cuales el 82% eran Actinomyces. Esto indicó que Actinomyces era la principal comunidad microbiana en EBS. En 2016, Tripodi y col. utilizaron múltiples medios de cultivo microbiano para sedimentación negra, y los resultados mostraron que Actinomyces spp. representaba el 63% del total de microorganismos cultivables, Streptococcus spp. el 31%, Capnocytophaga spp. y Fusobacterium el 2%, respectivamente y Actinomyces actinomycetemcomitans y Neisseria spp. el 1%, respectivamente. Estos resultados sugirieron que Actinomyces podría ser una comunidad microbiana específica en la formación de EBS. Las cepas de esta flora microbiana podrían ser las principales bacterias patógenas de EBS, lo que proporcionó un objetivo específico para la prevención y el tratamiento de EBS.
Hipótesis del “microbioma central”. Después del año 2000, con el desarrollo de la teoría de la biopelícula y los avances en la tecnología de cultivo y los métodos de biología molecular, más investigadores creyeron que la formación de EBS no se debía solo a una bacteria única o específica, sino también al “microbioma central”. El término “microbioma central” se refiere a un conjunto de taxones microbianos o al genoma que son característicos en un entorno definido. En los últimos años, muchos estudios adoptaron SPG para investigar la diversidad microbiana de las EBS. Sin embargo, múltiples estudios han demostrado diferentes patógenos potenciales en dichas muestras. La flora microbiana dominante reportada incluyó Actinomyces, Cardiobacterium, Haemophilus, Corynebacterium, Tannerella, Treponema, Leptotrichia, Fusobacterium, Streptococcus, Neisseria, Capnocytophaga, Pseudopropionibacterium, Rothia, Pseudomonas fluorescens, Aggregatibacter Prevotella, Bacteroides, Kingella y Lautropia. Algunos estudios hallaron que Actinomyces era significativamente abundante. Hirtz y col. utilizaron métodos proteómicos por primera vez para estudiar los microbiomas de EBS. Encontraron que Rothia, Kingella, Neisseria y Pseudopropionibacterium eran muy abundantes a nivel de género en el grupo EBS. Sin embargo, ningún microorganismo oral en particular fue compartido entre todos los estudios incluidos. Ningún experimento había verificado más a fondo las funciones de estos potenciales biomarcadores microbianos de EBS. Además, el impacto de la microbiota de abundancia media y baja en el entorno ecológico del EBS sigue siendo desconocido. Esto indicó que se deben realizar más investigaciones utilizando datos ómicos y validación experimental para confirmar la composición y estructura patógena del "microbioma central" de EBS.
Características del microbioma centralsEn base a las especulaciones actuales sobre los componentes fisicoquímicos de las EBS, se presentan las características de la microbiota central que se informaron en al menos 2 estudios incluidos.
Actinomyces. Es un bacilo anaeróbico facultativo gram positivo. Es parte de la flora microbiana oral normal y juega un rol importante en la formación de la biopelícula oral. Hasta ahora, se han identificado 33 especies en este género.
Prevotella nigrescens. Es un bacilo anaeróbico especializado gram negativo que forma una colonia negra en un medio de agar sangre y puede producir pigmentos que van desde el marrón oscuro a negro. Depende de la hemoglobina como fuente de hierro necesaria para su crecimiento. Podría producir H2S, que podría estar involucrado en la formación de EBS. Sin embargo, varios estudios no informaron diferencias significativas en las abundancias bacterianas relativas entre las muestras de EBS y las placas normales. Aunque puede producir una sustancia negra, podría no ser una bacteria patógena para EBS.
Pseudopropionibacterium. Es un bacilo anaeróbico facultativo gram positivo que pertenece a Actinobacteria, un miembro de la comunidad microbiana oral humana. En 2016, fue reclasificado como un nuevo género de bacterias de Propionibacterium. En la actualidad, hay 3 especies bacterianas conocidas, a saber, Pseudopropionibacterium propionicum, Pseudopropionibacterium rubrum y Pseudopropionibacterium massiliense. Las investigaciones han demostrado que la producción de H2S también podría detectarse en los metabolitos de P. propionicum. Curiosamente, estas 3 cepas bacterianas son colonias de color naranja oscuro, rojo o marrón en medios específicos, que se relacionan con la formación de EBS.
Neisseria. Es un diplococo aerobio obligado gram negativo, miembro de la microbiota normal del huésped. Este género contiene 31 especies bacterianas, entre las que Neisseria meningitidis y Neisseria gonorrhoeae pueden sintetizar cisteína. El H2S se puede producir a través del metabolismo de la cisteína, lo que indica que Neisseria podría estar asociada con la formación de EBS.
Leptotrichia. Es un bacilo anaerobio gram negativo que contiene 6 especies. Se encuentra comúnmente en la placa dental y se asocia con caries dental, enfermedad periodontal y absceso oral. Se encontró que Leptotrichia promueve la colonización de Fusobacterium en la cavidad oral, lo que podría contribuir a la formación de EBS en la dentición primaria. Fusobacterium podría coagregarse con bacterias cromogénicas, como Porphyromonas gingivalis y Prevotella melaninogenica, conduciendo a una mayor infección. Sin embargo, la asociación entre esta microbiota y el EBS aún necesita más investigación.
Rothia. Es un bacilo irregular gram positivo perteneciente a Actinobacteria, que comparte muchas características con Actinomyces. Este género tiene 11 especies bacterianas. Se encontró un gen biosintético similar al catecol-sideróforo posiblemente asociado con EBS enRothia mucilaginosa, Rothia dentocariosa y Rothia aeria.
ConclusionesEn conclusión, la formación de EBS se consideró relacionada con el "microbioma central", como Actinomyces, Prevotella nigrescens, Pseudopropionibacterium, Leptotrichia, Neisseria y Rothia. Sin embargo, sigue habiendo controversia debido a las diferencias en los métodos de investigación y los diseños experimentales. La patogenia del EBS aún no está clara porque los métodos de investigación actuales solo identifican la flora microbiana a nivel de género.
Los autores proponen las siguientes recomendaciones:
1) Para obtener información más específica sobre la comunidad microbiana, se recomienda la secuenciación de tercera generación con una longitud de lectura más larga para la secuenciación de amplificación del ARNr 16S. Además, se deben realizar estudios integrales de multiómica, por ejemplo, secuenciación de macrogenes, macroproteoma, metaboloma y transcriptoma, para obtener hallazgos más consistentes del microbioma central de EBS.
2) Es necesario cultivar y preservar los microorganismos relacionados con EBS o establecer un banco microbiano oral de EBS para futuros experimentos.
3) El mecanismo patogénico de EBS debe ser resuelto por múltiples disciplinas. La ayuda de los químicos es crucial para descubrir los componentes materiales de EBS, así como la posible reacción química entre y dentro del entorno microecológico. Basándose en estos hallazgos fundamentales, los microbiólogos deben identificar los microorganismos patógenos relevantes y establecer la relación entre los componentes químicos y los microorganismos. Combinado con valiosos hallazgos epidemiológicos y la experiencia clínica de los dentistas, un análisis integral y multidimensional de la patogénesis de EBS puede promover profundamente la prevención y el tratamiento
Autor/a: Xue Dong, Weijin Zhao, Sha Ma, Ximeng Li, Guiding Li, Shinan Zhang
Fuente: Journal of Dental Sciences 19 (2024),1369-1379
Tomado de intrmed.net