Aerosol y estabilidad de la superficie del SARS-CoV-2 en comparación con el SARS-CoV-1
Abr 19 de 2020 0
Un nuevo coronavirus humano que ahora se llama coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) (anteriormente llamado HCoV-19) surgió en Wuhan, China, a fines de 2019 y ahora está causando una pandemia. 1 Se analizó el aerosol y la superficie de la estabilidad de SARS-CoV-2 y la comparó con SARS-CoV-1, el coronavirus humano relacionado más de cerca. 2
Evaluamos la estabilidad de SARS-CoV-2 y SARS-CoV-1 en aerosoles y en varias superficies y estimamos sus tasas de descomposición utilizando un modelo de regresión bayesiano (consulte la sección Métodos en el Apéndice complementario , disponible con el texto completo de esta carta). en NEJM.org). Las cepas utilizadas fueron SARS-CoV-2 nCoV-WA1-2020 (MN985325.1) y SARS-CoV-1 Tor2 (AY274119.3). Los aerosoles (<5 m) que contiene SARS-CoV-2 (10 5,25 50% de cultivo de tejidos dosis infecciosa [TCID 50 ] por mililitro) o SARS-CoV-1 (10 6,75-7,00 TCID 50por mililitro) se generaron con el uso de un nebulizador Collison de tres chorros y se alimentaron a un tambor Goldberg para crear un ambiente en aerosol. El inóculo dio como resultado valores de umbral de ciclo entre 20 y 22, similares a los observados en muestras obtenidas del tracto respiratorio superior e inferior en humanos.
Nuestros datos consistieron en 10 condiciones experimentales con dos virus (SARS-CoV-2 y SARS-CoV-1) en cinco condiciones ambientales (aerosoles, plástico, acero inoxidable, cobre y cartón). Todas las mediciones experimentales se informan como medias en tres réplicas.
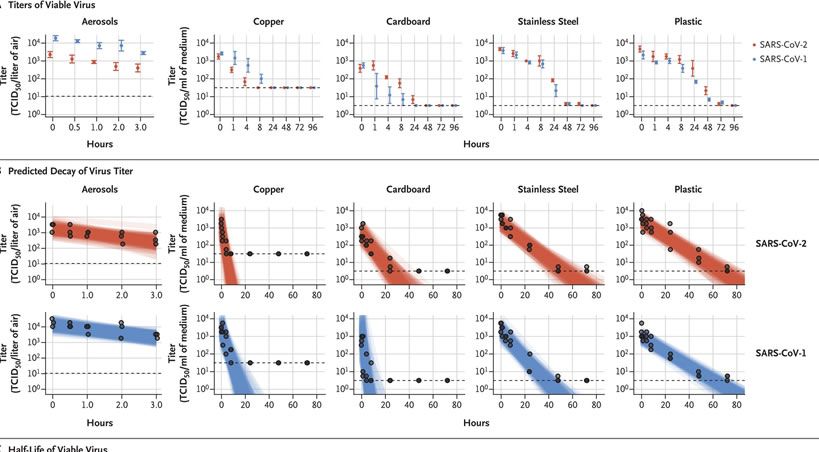
El SARS-CoV-2 permaneció viable en aerosoles durante la duración de nuestro experimento (3 horas), con una reducción en el título infeccioso de 10 3.5 a 10 2.7 TCID 50 por litro de aire. Esta reducción fue similar a la observada con SARS-CoV-1, de 10 4.3 a 10 3.5 TCID 50 por mililitro ( Figura 1A ).
El SARS-CoV-2 fue más estable en plástico y acero inoxidable que en cobre y cartón, y se detectó un virus viable hasta 72 horas después de la aplicación en estas superficies ( Figura 1A ), aunque el título del virus se redujo considerablemente (de 10 3.7 a 10 0.6 TCID 50 por mililitro de medio después de 72 horas en plástico y de 10 3.7 a 10 0.6 TCID 50 por mililitro después de 48 horas en acero inoxidable). La cinética de estabilidad del SARS-CoV-1 fue similar (de 10 3.4 a 10 0.7 TCID 50 por mililitro después de 72 horas en plástico y de 10 3.6 a 10 0.6 TCID50 por mililitro después de 48 horas en el acero inoxidable). En cobre, no se midió el SARS-CoV-2 viable después de 4 horas y no se midió el SARS-CoV-1 viable después de 8 horas. Sobre cartón, no se midió el SARS-CoV-2 viable después de 24 horas y no se midió el SARS-CoV-1 viable después de 8 horas ( Figura 1A ).
Ambos virus tuvieron una disminución exponencial en el título del virus en todas las condiciones experimentales, como lo indica una disminución lineal en el log 10 TCID 50 por litro de aire o mililitro de medio a lo largo del tiempo ( Figura 1B ). La vida media de SARS-CoV-2 y SARS-CoV-1 fue similar en aerosoles, con estimaciones medias de aproximadamente 1.1 a 1.2 horas e intervalos creíbles de 95% de 0.64 a 2.64 para SARS-CoV-2 y 0.78 a 2.43 para SARS-CoV-1 ( Figura 1C , y Tabla S1 en el Apéndice Complementario) La vida media de los dos virus también fue similar en el cobre. En cartón, la vida media del SARS-CoV-2 fue más larga que la del SARS-CoV-1. La viabilidad más larga de ambos virus fue en acero inoxidable y plástico; La vida media estimada del SARS-CoV-2 fue de aproximadamente 5.6 horas en acero inoxidable y 6.8 horas en plástico ( Figura 1C ). Las diferencias estimadas en la vida media de los dos virus fueron pequeñas, excepto en las de cartón ( Figura 1C ). Los datos de réplica individuales fueron notablemente más "ruidosos" (es decir, hubo más variación en el experimento, lo que resultó en un error estándar mayor) para el cartón que para otras superficies (Fig. S1 a S5), por lo que recomendamos precaución al interpretar este resultado.
Encontramos que la estabilidad del SARS-CoV-2 era similar a la del SARS-CoV-1 en las circunstancias experimentales probadas. Esto indica que las diferencias en las características epidemiológicas de estos virus probablemente surgen de otros factores, incluidas las altas cargas virales en el tracto respiratorio superior y la posibilidad de que las personas infectadas con SARS-CoV-2 eliminen y transmitan el virus mientras están asintomáticos. 3,4 Nuestros resultados indican que la transmisión de SARS-CoV-2 en aerosol y fomita es plausible, ya que el virus puede permanecer viable e infeccioso en aerosoles durante horas y en superficies hasta días (dependiendo del cobertizo del inóculo). Estos hallazgos hacen eco de aquellos con SARS-CoV-1, en los cuales estas formas de transmisión se asociaron con propagación nosocomial y eventos de súper propagación, 5 y proporcionan información para los esfuerzos de mitigación de pandemias.

Neeltje van Doremalen, Ph.D.
Trenton Bushmaker, B.Sc.
Instituto Nacional de Alergias y Enfermedades Infecciosas, Hamilton, MT
Dylan H. Morris, M. Phil.
Universidad de Princeton, Princeton, NJ
Myndi G. Holbrook, B.Sc.
Instituto Nacional de Alergias y Enfermedades Infecciosas, Hamilton, MT
Amandine Gamble, Ph.D.
Universidad de California, Los Angeles, Los Angeles, CA
Brandi N. Williamson, MPH
Instituto Nacional de Alergias y Enfermedades Infecciosas, Hamilton, MT
Azaibi Tamin, Ph.D.
Jennifer L. Harcourt, Ph.D.
Natalie J. Thornburg, Ph.D.
Susan I. Gerber, MD
Centros para el Control y la Prevención de Enfermedades, Atlanta, GA
James O. Lloyd-Smith, Ph.D.
Universidad de California, Los Ángeles, Los Ángeles, CA, Bethesda, MD
Emmie de Wit, Ph.D.
Vincent J. Munster, Ph.D.
Instituto Nacional de Alergias y Enfermedades Infecciosas, Hamilton, MT
vincent.munster@nih.gov
Apoyado por el Programa de Investigación Intramural del Instituto Nacional de Alergias y Enfermedades Infecciosas, Institutos Nacionales de Salud, y por contratos de la Agencia de Proyectos de Investigación Avanzada de Defensa (DARPAPREMIO No. D18AC00031, a los Dres. Lloyd-Smith y Gamble), de laFundación Nacional de Ciencia (DEB-1557022, al Dr. Lloyd-Smith), y del Programa Estratégico de Investigación y Desarrollo Ambiental del Departamento de Defensa (SERDP, RC-2635, al Dr. Lloyd-Smith).
Los formularios de divulgación proporcionados por los autores están disponibles con el texto completo de esta carta en NEJM.org.
Los hallazgos y conclusiones en esta carta son los de los autores y no representan necesariamente la posición oficial de los Centros para el Control y la Prevención de Enfermedades (CDC). Los nombres de vendedores, fabricantes o productos específicos se incluyen con fines de salud pública e informativos; la inclusión no implica el respaldo de los vendedores, fabricantes o productos por parte de los CDC o el Departamento de Salud y Servicios Humanos.
Esta carta fue publicada el 17 de marzo de 2020 en NEJM.org.
El Dr. van Doremalen, el Sr. Bushmaker y el Sr. Morris contribuyeron igualmente a esta carta.
REFERENCIAS
-
Informes de situación de la enfermedad por coronavirus (COVID-2019). Ginebra: Organización Mundial de la Salud, 2020 ( https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports/ . Se abre en una pestaña nueva)
-
2.Wu A , Peng Y , Huang B , et al. Composición del genoma y divergencia del nuevo coronavirus (2019-nCoV) originario de China. Cell Host Microbe 2020 ; 27: 325 - 328
-
3.Bai Y , Yao L , Wei T , et al. Presunta transmisión portadora asintomática de COVID-19. JAMA 2020 21 de febrero (Epub antes de la impresión)
-
4.Zou L , Ruan F , Huang M , et al. Carga viral de SARS-CoV-2 en muestras de las vías respiratorias superiores de pacientes infectados. N Engl J Med 2020 ; 382: XXX - XXX
-
5.Chen YC , Huang LM , Chan CC , et al. SARS en la sala de emergencias del hospital. Emerg Infect Dis 2004 ; 10: 782 - 788 .
Fuente: nejm.org