Inhibir la replicación SARS-CoV-2 con irradiación UV-C
Oct 28 de 2020 0
Andrea Bianco1, §, Mara Biasin2,§, Giovanni Pareschi1, Adalberto Cavalieri3, Claudia Cavatorta3, Claudio Fenizia2, Paola Galli1, Luigi Lessio4, Manuela Lualdi5, Edoardo Redaelli1, Irma Saulle2,6, Daria Trabattoni2, Alessio Zanutta1, Mario Clerici6,7,*
1 instituto Nacional Italiano de Astrofísica (INAF) – Observatorio Astronómico de Brera, Merate, Italia.
2 departamento de Ciencias Biomédicas y Clínicas L. Sacco, Universidad de Milán, Milano, Italia.
3 unidad de Epidemiología y Prevención, Fundación IRCCS, Instituto Nacional de Tumor, Milán, Italia.
4 instituto Nacional Italiano de Astrofísica (INAF) – Observatorio Astronómico de Padua, Padua, Italia.
5 departamento de Diagnóstico por Imagen y Radioterapia, Fundación IRCCS, Instituto Nacional de Tumor, Milán, Italia.
6 departamento de Fisiopatología y Trasplante, Universidad de Milán, Milán, Italia.
7Don C. Fundación Gnocchi, Fundación IRCCS, Milano, Italia.
Los posibles efectos virucidas de la irradiación UV-C en SARS-CoV-2 se evaluaron experimentalmente para diferentes dosis de iluminación y concentraciones de virus (1000, 5, 0,05 MOI). Tanto la inactivación del virus como la inhibición de la replicación se investigaron en función de estos parámetros. Con una densidad de virus comparable a la observada en la infección por SARS-CoV-2, se observó una dosis UV-C de solo 3,7 mJ/cm2 para lograr una inactivación de 3 registros, y se observó una inhibición completa de todas las concentraciones virales con 16,9 mJ/cm2 . Estos resultados podrían explicar las tendencias epidemiológicas de COVID-19 y son importantes para el desarrollo de nuevos métodos de esterilización para contener la infección por SARS-CoV-2.
La pandemia COVID-19 causada por el virus SARS-CoV-21 ha tenido un enorme impacto, aún apenas entendido, en la salud y las perspectivas económicas a nivel mundial2. La identificación de enfoques eficaces de microbicidas es de suma importancia para limitar la propagación viral adicional, ya que el virus puede transmitirse a través de aerosol3 y puede sobrevivir durante horas fuera del cuerpo4. En este contexto, las tecnologías de desinfección sin contacto son muy deseables, y la radiación UV, en particular UV-C (200 – 280 nm), es uno de los enfoques más fiables y ampliamente aceptados5-8. La interacción de las radiaciones UV-C con los virus ha sido ampliamente estudiada9, y el mecanismo más común consiste en la absorción directa del fotón UV-C por la base de ácido nucleico y/o proteínas de la cápside que conducen a la generación de foto productos que inactivan el virus10,11. Algunos modelos han sido propuestos para correlacionar la estructura del ácido nucleico con la dosis necesaria para inactivar el virus, pero estamos lejos de ser un modelo confiable12. Esto también se debe al hecho de que las mediciones UV-C se llevaron a cabo utilizando diferentes virus y diversas condiciones experimentales13-16. Esto dio lugar a una gama extremadamente amplia de valores para el mismo virus y, por ejemplo, en el caso de los valores SARS-COV-1 reportados en la literatura oscilan entre unos pocos mJ/cm2 y cientos mJ/cm2 13,16,17. Por lo tanto, es crucial tener evidencias de mecanismo de desinfección UV-C en SARS-CoV-2 con las dosis correspondientes, sabiendo que la luz UV de la luz solar parece ser eficiente en la inactivación del virus18.
Aquí, informamos del efecto de UV-C monocromático (254 nm) en SARS-CoV-2, mostrando que tanto la inactivación como la inhibición del virus se pueden lograr fácilmente. Los experimentos se llevaron a cabo utilizando un sistema de lámpara de mercurio de baja presión diseñado a medida, que ha sido calibrado espectralmente proporcionando una intensidad media de 1.082 mW/cm2 sobre el área de iluminación (ver la información complementaria para los detalles). Tres tiempos diferentes de exposición a la iluminación, correspondientes a 3,7, 16,9 y 84,4 mJ/cm2, se administraron a SARS-CoV-2, ya sea a una multiplicidad de infección (MOI) de 0,05, 5, 1000. La primera concentración es equivalente a la contaminación de bajo nivel observada en ambientes cerrados (por ejemplo, salas hospitalarias), la segunda corresponde a la concentración media encontrada en el esputo de pacientes infectados con COVID-19, y la tercera es una concentración muy grande, correspondiente a la observada en pacientes con enfermedad terminal COVID-1919. Después de la exposición a UV-C, la replicación viral fue evaluada por Reacción en Cadena de Polimerasa en Tiempo Real (PCR) dirigida a dos regiones (N1 y N2) del gen nucleocápside SARS-CoV-2, así como mediante el análisis del efecto citopático inducido por SARS-CoV-2. Se realizaron análisis en el sobrenadante de cultivo de células infectadas en tres puntos de tiempo diferentes (24, 48 y 72 horas para SARS-CoV-2 en MOI 1000 y 5; 24, 48 horas y 6 días para SARS-CoV-2 en MOI 0.05), así como en lisados celulares al final del cultivo celular (72 horas: MOI 1000 y 5; 6 días: MOI 0.05).
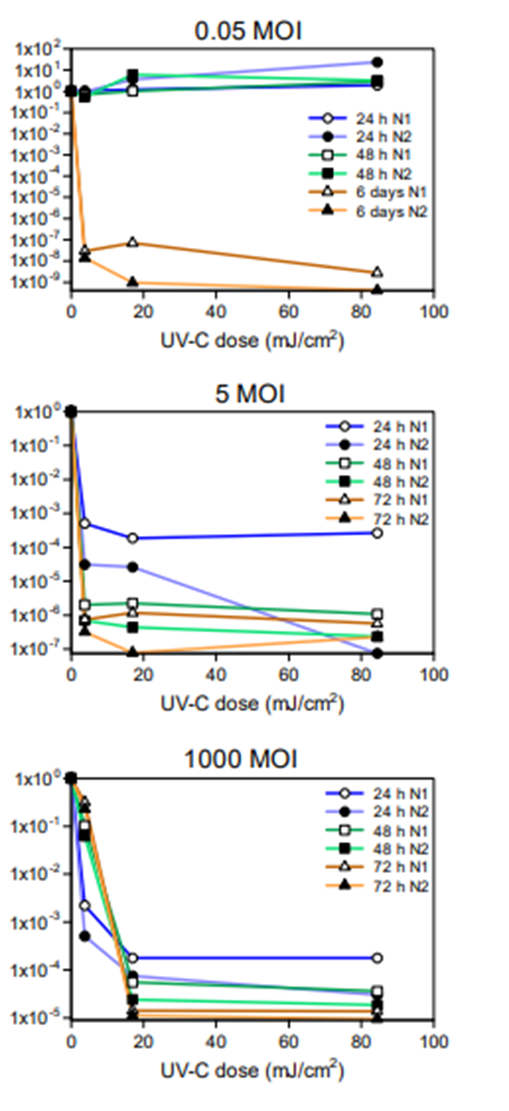
El efecto de la exposición a los rayos UV-C fue extremadamente evidente independientemente del MOI empleado; se observaron curvas dependientes del tiempo y una curva dependiente del tiempo. La Figura 1 informa del número de copias SARS-CoV-2 para las tres concentraciones en función de la dosis UV-C y el tiempo, cuantificados en una curva estándar a partir de un control de plásmido (las curvas normalizadas correspondientes se informan en la Información Complementaria, figura S3).
Figura 1. Replicación viral del virus SARS-CoV-2 irradiado por UV en células VeroE6 in vitro. Las células Vero E6 se infectaron con el virus SARS-CoV-2 irradiado UV-C a un MOI de 0,05 (A, B y C), 5 (D, E y F) o 1000 (G, H e I). Los sobrenadantes de cultivo se cosecharon en los tiempos indicados (24, 48 72 horas y 6 días) y los títulos de virus se midieron mediante la cuantificación absoluta del número de copia (PCR en tiempo real) (A, B, D, E, G y F). La replicación viral se evaluó en el alate celular cosechado al final de los cultivos celulares a las 72 horas (5 y 1000 MOI) (panel F e I) y a 6 días (0,05 MOI) (Panel C) después de la infección. Todas las condiciones de cultivo celular se sembraron por duplicado. (L) No se observó ningún efecto citopático en monocapas VeroE6 cultivadas no infectadas mantenidas en un medio completo tratado con UV de 50mJ/cm2 durante 72 horas. (M) La infección in vitro de las células VeroE6 no tratadas con SARS-CoV-2 (5 MOI) dio lugar a un efecto citopático evidente. (N) La irradiación SARS- CoV-2 con 3,7 mJ/cm2 UV-C rescató el efecto citopático inducido por el virus UV-C no tratado.
No se pudo observar la replicación viral durante las primeras 48 horas con la concentración más baja (0,05 MOI) en muestras no tratadas o irradiadas por UV-C. Sin embargo, 6 días después de la infección la replicación viral fue claramente evidente en la condición no expuesta de UV-C, pero se inhibió completamente después de la irradiación UV-C incluso en 3,7 mJ/cm2 en ambos sobrenadantes de cultivo celular (Figura1, panel A y B, figura S3) y izado celular (Figura 1, panel C).A la concentración viral intermedia (5 MOI), una reducción efectiva del número de 3,7 mJ/cm2 dosis con una disminución de un factor de 2000 (> disminución de 3 registros) después de 24 horas (Figura 1, panel D y Figura S3) se observó. Aún más importante, el valor del número de copia no aumentó con el tiempo, lo que sugiere una inactivación efectiva del virus, confirmada aún más por la evaluación del efecto citopático (Figura1, panel L, M y N). Las dosis UV-C más altas siguieron la misma tendencia (Figura 1, panel D y E). La evaluación de la replicación viral a nivel intracelular corroboró aún más el efecto antiviral UV-C (Figura 1, panel F). Por lo tanto, en esta entrada viral la exposición a una dosis mínima de 3,7 mJ/cm22 resulta en agotamiento viral. El resultado fue diferente con la mayor entrada viral (1000 MOI). De hecho, la replicación viral disminuyó significativamente de manera dependiente de la dosis UV-C tan pronto como 24 horas con un factor de 103 a 3,7 mJ/cm2 y 104 a 16,9 mJ/cm2 (como se indica en la figura S3). Después de 48 horas, la concentración viral aumentó en cultivos expuestos a la dosis más baja de UV-C, mientras que se mantuvo estable para las dosis de 16,9 y 84,4 mJ/cm2, de acuerdo con los resultados a las 72 horas (Figura 1, panel G y H). Los resultados se confirmaron mediante la evaluación de la replicación viral a nivel intracelular (Figura 1, panel I). Esto indica claramente que la entrada viral residual dejada por el 3,7 mJ/cm2 fue capaz de replicarse y suficiente para generar una infección efectiva. Por lo tanto, la inactivación parcial de la entrada viral condujo a una inhibición de la infección. Este no es el caso en cultivos expuestos a dosis más altas de UV-C, ya que no se pudo detectar ninguna replicación en estas condiciones.
En conclusión, la radiación UV-C inhibe el SARS-CoV-2 y la respuesta depende tanto de la dosis UV-C como de la concentración del virus. De hecho, para las concentraciones de virus típicas de ambiente cerrado contaminado de bajo nivel y esputo de pacientes infectados por COVID-19, una dosis muy pequeña de menos de 4 mJ/cm2 fue suficiente para lograr la inactivación completa del virus. Incluso en la concentración de entrada viral más alta (1000 MOI), la replicación viral se inactivaba totalmente a una dosis >16,9 mJ/cm2. Estos resultados son extremadamente importantes, ya que permiten diseño y desarrollo adecuados de métodos eficientes de desinfección a base de rayos UV para contener la infección por SARS-CoV-2.
Agradecimientos
Esta investigación fue apoyada parcialmente por una subvención de Falk Renewables y se ha llevado a cabo en el contexto de las actividades promovidas por el Gobierno italiano y, en particular, por los Ministerios de Salud y de Universidad e Investigación, contra la pandemia COVID-19. Los autores están agradecidos al Presidente del INAF, Prof. N. D'Amico, por el apoyo y por una lectura crítica del manuscrito.
Referencias
1. Zhu, N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N. Engl. J. Med.
382, 727–733 (2020).
2. Cobey, S. Modeling infectious disease dynamics. Science. 368, 713–714 (2020).
3. van Doremalen, N. et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1.
N. Engl. J. Med. 382, 1564–1567 (2020).
4. Stadnytskyi, V., Bax, C. E., Bax, A. & Anfinrud, P. The airborne lifetime of small speech droplets and their potential importance in SARS-CoV-2 transmission. Proc. Natl. Acad. Sci. 202006874 (2020) doi:10.1073/pnas.2006874117.
5. Pirnie, M., Linden, K. G. & Malley, J. P. J. Ultraviolet disinfection guidance manual for the final long term 2 enhanced surface water treatment rule. Environ. Prot. 2, 1–436 (2006).
6. Reed, N. G. The history of ultraviolet germicidal irradiation for air disinfection. Public Health Rep.
125, 15–27 (2010).
7. Chang, J. C. et al. UV inactivation of pathogenic and indicator microorganisms. Appl. Environ. Microbiol. 49, 1361 –1365 (1985).
8. Kovalski, W. Ultraviolet germicidal irradiation handbook: UVGI for air and surface disinfection. (Springer Science & Business Media, 2010).
9. Rauth, A. M. The Physical State of Viral Nucleic Acid and the Sensitivity of Viruses to Ultraviolet Light. Biophys. J. 5, 257–273 (1965).
10. Qiao, Z. & Wigginton, K. R. Direct and Indirect Photochemical Reactions in Viral RNA Measured with RT-qPCR and Mass Spectrometry. Environ. Sci. Technol. 50, 13371–13379 (2016).
11. Wigginton, K. R. & Kohn, T. Virus disinfection mechanisms: the role of virus composition, structure, and function. Curr. Opin. Virol. 2, 84–89 (2012).
12. Lytle, C. D. & Sagripanti, J.-L. Predicted Inactivation of Viruses of Relevance to Biodefense by Solar Radiation. J. Virol. 79, 14244–14252 (2005).
13. Walker, C. M. & Ko, G. Effect of Ultraviolet Germicidal Irradiation on Viral Aerosols. Environ. Sci. Technol. 41, 5460–5465 (2007).
14. McDevitt, J. J., Rudnick, S. N. & Radonovich, L. J. Aerosol susceptibility of influenza virus to UV-C light. Appl. Environ. Microbiol. 78, 1666–1669 (2012).
15. Calgua, B. et al. UVC Inactivation of dsDNA and ssRNA Viruses in Water: UV Fluences and a qPCR- Based Approach to Evaluate Decay on Viral Infectivity. Food Environ. Virol. 6, 260–268 (2014).
16. Eickmann, M. et al. Inactivation of three emerging viruses – severe acute respiratory syndrome coronavirus, Crimean–Congo haemorrhagic fever virus and Nipah virus – in platelet concentrates by ultraviolet C light and in plasma by methylene blue plus visible light. Vox Sang. 115, 146–151 (2020).
17. Duan, S.-M. et al. Stability of SARS Coronavirus in Human Specimens and Environment and Its Sensitivity to Heating and UV Irradiation. Biomed. Environ. Sci. 16, 246–255.
18. Ratnesar-Shumate, S. et al. Simulated Sunlight Rapidly Inactivates SARS-CoV-2 on Surfaces. J. Infect. Dis. 1–9 (2020) doi:10.1093/infdis/jiaa274.
19. Wölfel, R. et al. Virological assessment of hospitalized patients with COVID-2019. Nature 581, 465– 469 (2020).
Información complementaria
La irradiación UV-C es altamente eficaz para inactivar e inhibir la replicación SARS-CoV-2
Andrea Bianco1, Mara Biasin2,Giovanni Pareschi1, Adalberto Cavalieri3, Claudia Cavatorta3, Claudio Fenizia2, Paola Galli1, Luigi Lessio4, Manuela Lualdi5, Edoardo Redaelli1, Irma Saulle2,6, Daria Trabattoni2, Alessio Zanutta1, Mario Clerici6,7,*
1 Instituto Nacional Italiano de Astrofísica (INAF) – Observatorio Astronómico de Brera, Merate, Italia.
2 Departamento de Ciencias Biomédicas y Clínicas L. Sacco, Universidad de Milán, Milano, Italia.
3 Unidad de Epidemiología y Prevención, Fundación IRCCS, Istituto Nazionale dei Tumori, Milán, Italia..
4 Instituto Nacional Italiano de Astrofísica (INAF) – Observatorio Astronómico de Padua, Padua, Italia.
5 Departamento de Diagnóstico por Imagen y Radioterapy, Fundación IRCCS, Istituto Nazionale dei Tumori, Milán, Italia..
6 Departamento de Fisiopatología y Trasplante, Universidad de Milán, Milano, Italia.
7Fundación Don C. Gnocchi, Fundación IRCCS, Milán, Italia.
Ensayo in vitro de infección por SARS-CoV-2
3 x 105 células VeroE6 se cultivaron en DMEM (Euroclone, Milán, Italia) con 2 % de medio FBS, con 100 U/ml de penicilina y 100 g/ml de estreptomicina, en una placa de 24 pozos un día antes del ensayo de infección viral. SARS-CoV-2 (Virus Human 2019-nCoV cepa 2019- nCoV/Italia-INMI1, Roma, Italia) en una multiplicidad de infección (MOI) de 1000, 5 y 0.05 fueron tratados con diferentes dosis de radiación UV-C (ver la sección dedicada) antes de inóculo en células VeroE6. El virus no tratado por UV-C sirvió como controles positivos. Los cultivos celulares se incubaron con el virus inóculo por duplicado durante tres horas a 37oC y 5% de CO2. Luego, las células se enjuagaron tres veces con PBS caliente, se repusieron con el medio de crecimiento adecuado y se observaron diariamente para el efecto citopático. La replicación viral en los sobrenadantes de cultivo se evaluó en 24, 48 y 72 horas después de la infección (hpi), mientras que las células infectadas se cosecharon para la recolección de ARN a 72 hpi. Los cultivos celulares de SARS-CoV-2 a 0,05 MOI se cosecharon 6 días después de la infección. El ARN fue extraído del sobrenadante de cultivo celular VeroE6 y el lisado celular por el Instrumento RSC Maxwell® con Maxwell® RSC Viral Total Nucleic Acid Purification Kit (Promega, Fitchburg, WI, USA) y retroadministrado en ADNC como se describió anteriormente (Promega, Fitchburg, WI, USA). La PCR en tiempo real se realizó en un CFX96 (Bio-Rad, CA, EE. UU.) utilizando el kit de emergencia de ensayo de sonda qPCR de CDC qPCR 2019-nCoV (IDT, Iowa, EE. UU.), que se dirige a dos regiones (N1 y N2) del gen nucleocapsid del SARS-CoV-2. La cuantificación de copias virales se evaluó mediante la creación de una curva estándar a partir del Control de Plásmido positivo cuantificado 2019-nCoV_N (IDT, Iowa, EE. UU.).
Prueba de radiación UV
La radiación de la solución antivirus se llevó a cabo utilizando una lámpara de mercurio de baja presión montada en un soporte diseñado a medida, que consiste en una caja con una abertura circular de 50 mm de diámetro colocada a aproximadamente 220 mm de la fuente. La abertura funciona como un filtro espacial para hacer la iluminación del área detrás de más uniforme. También hay un obturador mecánico para iniciar el proceso de iluminación. La placa se coloca 30 mm por debajo de la abertura circular y una sola morada (34,7 mm de diámetro), centrada con respecto a la apertura de 50 mm, ha sido irradiada desde la parte superior. La permanencia se llenó con 0,976 ml del virus suspendido en el Medio de águila modificada (DMEM) de Dulbecco para tener una capa líquida de 1 mm de espesor. Después de la rradiación, la muestra fue tratada como se describe en la sección anterior.
La intensidad de la lámpara y sus propiedades espectrales se han medido utilizando un espectrómetro Ocean Optics HR2000+ (Ocean Optics Inc., Dunedin, USA). El espectrómetro HR2000+ fue calibrado contra una fuente de deuterio-halógeno de referencia (Ocean Optics Inc. Winter Park, Winter Park, Florida) y en cumplimiento con las prácticas del Instituto Nacional de Estándares y Tecnología (NIST) recomendadas en el Manual 150- 2E del NIST, Guía técnica para mediciones de radiación óptica. La última calibración se realizó en marzo de 2019. El detector de nuestro espectrómetro es una matriz de dispositivos acoplados (CCD) de alta sensibilidad de 2048 elementos de Sony. El rango espectral es de 200-1100 nm con una ranura de entrada de 25 m de ancho y una resolución óptica de 1,4 nm (FWHM). La sonda de irradiancia corregida por coseno, modelo CC-3-UV-T, está unida a la punta de una fibra óptica de 1 m de largo y se acopla al espectrómetro. La intensidad de la lámpara se ha medido colocando el espectrómetro en cinco posiciones: en el centro y en los extremos de un brazo cruzado de 20 mm después de un tiempo de calentamiento de 30 s. Los espectros en las cinco posiciones se informan en la figura S1 junto con un esquema de la zona habitada e iluminada .
Figura S1. Espectro de lámparas de mercurio medido en las cinco posiciones. Inserción: esquema de la morada iluminada y la posición de medición.
Como era de esperar, la emisión está dominada por la línea UV-C y su intensidad fue uniforme en la zona con un valor medio de 1082 uW/cm2. La estabilidad de la lámpara se evaluó en +/- 11 uW/cm2 durante una medición de 130 s. Según este valor, se fijaron tres tiempos de exposición: 5, 23 y 114 s (con una precisión de 0,2s), que corresponden a las siguientes dosis: 5,5, 25,0, 124,4 mJ/cm2. Esta es la dosis UV nominal proporcionada a la morada, pero nos interesaron las dosis efectivas que llegan al virus. Por lo tanto, medimos el espectro de absorción UV-vis del medio de águila modificada (DMEM) del Dulbecco en una cubeta de cuarzo (1 mm de espesor) por medio de un espectrofotómetro Jasco V770 (Figura S2). Este espesor es el mismo de la solución en la permanencia durante el paso de irradiación UV.
Figura S2. Espectro de transmisión UV-vis del medio de águila modificada (DMEM) del Dulbecco en una cubeta de cuarzo de 1 mm.
La transmisión a 254 nm ha sido corregida en primer lugar por las pérdidas de reflexión de la cubeta de cuarzo; entonces, se ha tenido en cuenta la pérdida de reflexión debida a la interfaz aire-agua y una transmisión final de 0,68 a 254 nm se calculó. Según este valor, las dosis efectivas proporcionadas a los virus fueron: 3,7 x 0,15, 16,9 x 0,2 y 84,4 x 0,9 mJ/cm2.
Trazas de la fracción del virus en función de la dosis UV y el tiempo.