Gran descarga purulenta bucal asociada a candida dublinensis
May 31 de 2021 0
Se presenta el caso de un joven de 14 años, con Síndrome de Down, que padece una gran descarga purulenta bucal desde hace seis años, clínicamente evidente al despertar.
Varios estudios demostraron presencia de microbiota habitual y con Candida ssp. Durante todo ese tiempo, el cuadro fue refractario a los tratamientos antimicrobianos y antimicóticos convencionales.
La mucosa de labios, y lengua, muestra lesiones papilomatosas compatibles con las observadas en el Síndrome de Cowden.
Se estudió el material de la descarga y a través de la tipificación se diagnosticó Candida dubliniensis, determinando además la sensibilidad al voriconazol con el método de susceptibilidad antifúngica.
La descarga se resolvió con tratamiento en base a voriconazol.
Se pretende destacar la presencia de material purulento de origen micótico y la importancia de la tipificación y susceptibilidad antifúngica ante cuadros resistentes al fluconazol.
Reporte del casoEl caso corresponde a un niño de 14 años, con Síndrome de Down, quien es derivado a la consulta, con una evolución de seis años, luego de recibir diferentes terapéuticas sin éxito.
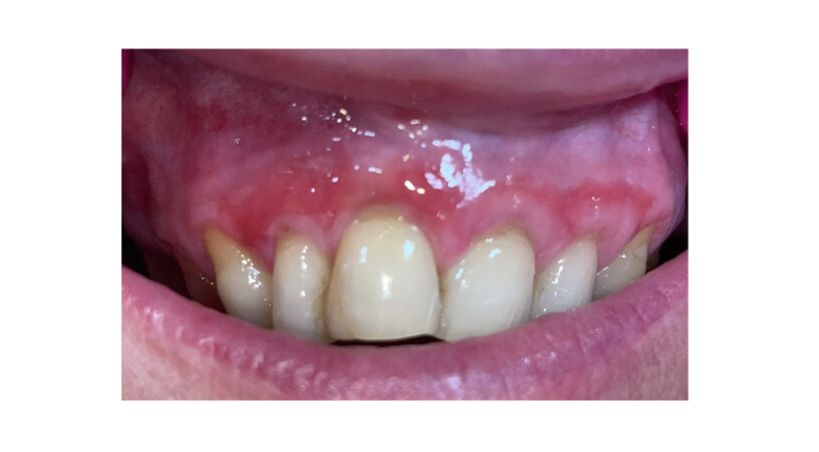
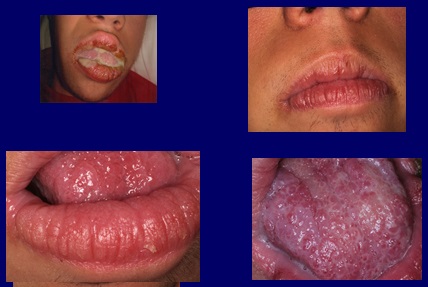
El niño padecía una descarga purulenta, bien notable por las mañanas al despertar, saliendo de la boca por la comisura, derramándose sobre la piel de la cara y la almohada (Fig. 1).
Los diferentes estudios microbiológicos y micológicos que se realizaron durante los seis años de la enfermedad, informaban: microbiota normal y con presencia de Candida ssp. Con ese diagnóstico, recibió grandes dosis de antibióticos y antimicóticos por largos períodos sin resultado. También se le indicaron enjuagues bucales de diferentes características sin respuesta.
Es celíaco y diabético, no existiendo otras alteraciones para destacar, más allá de las características de su enfermedad de base.
Refiere una cirugía bucal en un Hospital, para extirpar un quiste dentígero en paladar en zona 22, a los 8 años, sin complicaciones postoperatorias.
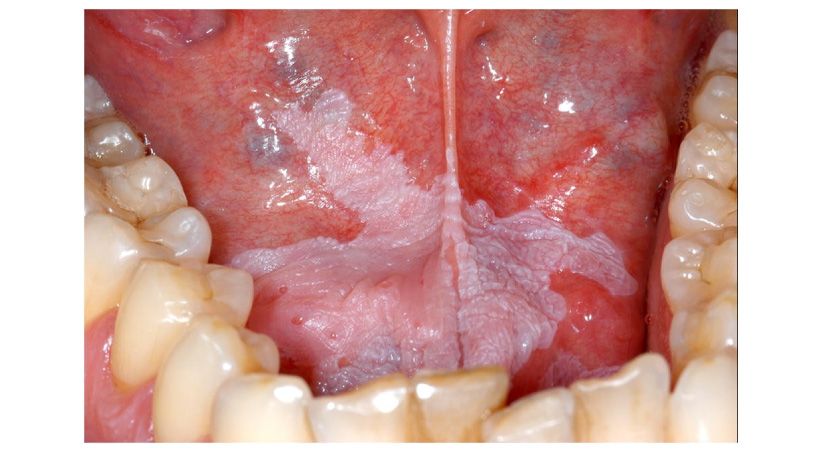
Llama la atención la característica de la mucosa labial y lingual, que presenta una superficie irregular de aspecto papilomatoso dejando surcos profundos ente las elevaciones, especialmente en labio inferior (Fig. 2).
Si bien, como se sabe, la estructura anatómica de la boca en este síndrome, se presenta con características diferenciadas, la madre asegura que ese aspecto de la mucosa, coincide con la aparición de la descarga purulenta nocturna. También asocia el origen del cuadro al tiempo de su internación para la cirugía del quiste dentígero. Existe una gran coincidencia clínica con las lesiones mucosas observadas en el síndrome de Cowden.
Se indica biopsias de labio y lengua, con tinciones con H-E y PAS, cuyo informe anatomopatológico indica: Hiperplasia Epitelial Inflamatoria asociada a Candidiasis Crónica.
Se estudió al mismo tiempo tiroides, tracto digestivo y piel para descartar lesiones asociadas al Síndrome de Cowden, no encontrando evidencias de enfermedad.
Para investigar genéticamente si el paciente padecía Síndrome de Cowden, se solicita estudio molecular por secuenciación y microarray del gen PTEN extrayendo ADN de sangre periférica, amplificación de PCR con primers específicos para cada axon y purificación. Se realizó análisis de las secuencias de los productos amplificados de cada exón con analizador genético ABI PRIM 310. El resultado informa que en los exones 5,6,7,8, WILD TYPE no se observaron alteraciones.
Tratando de identificar el foco original que producía la descarga, se solicitan, análisis clínicos, TC, RNM de macizo cráneo facial, cuello y tórax, RX panorámica, ecografía de las glándulas salivales y examen otorrinolaringológico, resultando todos los exámenes sin particularidades de importancia para el caso.
Se indica un Perfil Inmunológico que informa que si bien se observan algunas alteraciones inmunológicas, todas ellas no son significativas. Se descarta APECED (poliendocrinopatía autoinmune-candidiasis-distrofia ectodérmica por sus siglas en inglés). Los niveles de paratohormona son normales. La ausencia de antecedentes familiares de candidiasis excluye defectos en STAT 1.
Si bien los estudios microbiológicos anteriores y los actuales que aportó la madre del niño estaban realizados en laboratorios confiables, se decide examinar al niño en el momento de despertarse y recoger nuevamente material de la descarga.
La muestra obtenida consistió en una secreción purulenta y el procesamiento de la misma se realizó en el laboratorio de Diagnóstico de la Cátedra de Microbiología y Parasitología de la Facultad de Odontología de la Universidad de Buenos Aires.
A partir de la muestra se realizaron exámenes directos mediante coloración de Gram y Giemsa. En la observación microscópica se evidenciaron escasos bacilos gram negativos, diplococos gram positivos y regular cantidad de células levaduriformes con seudomicelio. Se observó respuesta inflamatoria positiva con más de 5 polimorfonucleares neutrófilos por campo. 100 μl de la muestra se sembraron por dispersión con espátula de Drigalski en los siguientes medios de cultivo: Levine; CLDE; BHI; CHROMagar Candida® (CA) e incubados en condiciones de aerobiosis a 37ºC durante 48 horas. Además se sembró la muestra en medio Agar Sangre Lacada en condiciones de anaerobiosis a 37ºC durante 7 días. Se recuperaron exclusivamente de todos los medios cultivados colonias de células levaduriformes.
En el medio CA se aislaron 105 UFC/ml de colonias verdes de Candida spp. Para la tipificación se emplearon métodos fenotípicos y micromorfológicos. Se realizaron microcultivos en Agar Leche de la colonia aislada y se observó la formación de tubo germinativo luego de 3 horas de incubación a 37°C y la presencia de seudohifas y clamidoconidias luego de 48 horas a 28°C. Para la diferenciación entre las especies de Candida albicans y Candida dubliniensis, la cepa fue sembrada en Agar Staib (AS) a 30ºC durante 4 días y en Agar Sabouraud glucosado (ASG) a 45ºC durante 48 horas. En el medio AS se observó la presencia de seudohifas y clamidoconidias y no se obtuvo desarrollo en el ASG.
Se empleó el método por difusión en discos según el documento M44-A2 del CLSI para realizar la susceptibilidad antifúngica a las drogas fluconazol y voriconazol.
De acuerdo con las pruebas realizadas la cepa estudiada fue fenotipificada como
Candida dubliniensis, la cual resultó susceptible a voriconazol y resistente a fluconazol.
DiscusiónAl mismo tiempo que se buscaba el origen de la descarga, se descarta Papilomatosis Oral Florida. Eversole describe un caso de POF asociada a Síndrome de Down1.La anatomìa patològica fue negativa.
El síndrome de Cowden es un trastorno autosómico dominante caracterizado por tumores hamartomatosos múltiples de origen ectodérmico, mesodérmico y endodérmico. El trastorno se debe a mutaciones del gen PTEN. También fue negativo el estudio genético. Torre y Cruces publican un caso de Síndrome de Cowden y Síndrome de Down2.
Sorprendía la continuidad y la resistencia a la terapéutica de la descarga purulenta. Tratándose de un niño con Sindrome de Down la primera línea de defensa contra bacterias y virus, es decir, la inmunidad innata, está claramente alterada cualitativa y cuantitativamente. A menudo está disminuido el número de células NK y reducida la fagocitosis y la quimiotaxis de los polimorfonucleares y monocitos, con lo que disminuye la capacidad de matar directamente los agentes patógenos.
La segunda línea de defensa, la inmunidad adaptativa mediada por células T, suele estar también alterada en el síndrome de Down. Hay una producción reducida en células T DC4 y CD8, y un menor nivel de la citotoxicidad requerida para hacer frente a los agentes patógenos. Hay una reducción de los linfocitos B, y aunque los niveles de inmunoglobulinas pueden no estar disminuidos, está deprimida la citotoxicidad dependiente de anticuerpos pero mediada por las células NK3,4,5.
Los niños con el Sindrome de Down, presentan además una alteración cromosómica que afecta la estructura anatómica de la boca condicionando una mayor capacidad de adherencia de Candida en la mucosa afectada Estos hechos convierten a los niños portadores de este sindrome como grandes "cargadores" de levaduras predisponiéndolos a candidiasis bucal y otras infecciones3.
Aunque Candida albicans ha sido el agente más frecuente en la candidiasis orofaríngea en pacientes inmunosuprimidos, en estos últimos años su prevalencia ha disminuido favoreciéndose otras especies tales como C. tropicalis, C. glabrata, C. krusei y desde 1996, la nueva especie denominada C. dubliniensis.
En general, estas levaduras son consideradas microbiota normal de cavidad oral de los humanos. Por lo que se va a establecer una competencia entre C. albicans y C. dubliniensis8
Este uso prolongado de antifúngicos pueden eliminar la competencia de C. dubliniensis con otros hongos (principalmente C. albicans) y aumentar el riesgo de una candidosis orofaríngea9. Por su gran semejanza con C. albicans, es posible que exista un subregistro de los casos prevalentes.
En algunos estudios se ha asociado la candidosis por C. dubliniensis con otros factores como historia de uso de drogas intravenosas, enfermedades debilitantes de fondo que fueron tratados previamente (un período no mayor de los 9 meses) con fluconazol, pacientes VIH negativos, pero con enfermedades debilitantes de fondo como una diabetes descompensada y uso de drogas inmunosupresoras10.
Está descripta la infección intrahospitalaria por parte de Candida dubliniensis, lo que no nos permite descartar que en este caso se haya iniciado cuando el paciente fue operado de su lesión en paladar, como sostenía su madre12.
En el caso presentado, los pliegues papilomatosos causados por la acción de la infección micótica crónica constituían el reservorio ideal para mantener activa la infección por tantos años. Fig 3
El voriconazol, droga de elección en este caso, junto con el posaconazol y ravuconazol son derivados triazólicos fluorados llamados “azoles de segunda generación”, al igual que el fluconazol y el itraconazol.
Como todos los azoles, los derivados triazólicos ejercen su actividad a través de la inhibición de algunos de los numerosos pasos que conducen a la síntesis del ergosterol y de otros esteroles. Estos compuestos son componentes estructurales fundamentales de la membrana fúngica y cada uno de ellos tiene funciones específicas. Es importante monitorear los posibles efectos secundarios de la droga.
Se inicia el tratamiento con voriconazol 200 mg comprimidos, dos por día durante cuatro meses, obteniendo una reversión de los síntomas, desapareciendo la descarga y mejorando el aspecto clínico de la mucosa (Fig. 4). Se realizó un control clínico serológico para controlar posibles efectos secundarios de la droga, los que afortunadamente no se produjeron.
Conclusión
La Candida dubliniensis, ha emergido como un patógeno importante, especialmente en pacientes inmunocomprometidos con manifestaciones principalmente en cavidad oral.
El paciente con Síndrome de Down puede presentar desordenes inmunológicos y condiciones anatómicas especiales en la cavidad bucal que los hacen grandes “cargadores” de levaduras
La Candida dubliniensis, presenta ciertas dificultades en su identificación, en particular a la hora de ser diferenciada de Candida albicans. Esta diferenciación es importante debido a diferencias en cuanto a resistencia al tratamiento antifúngico. Aún así, existen pruebas bioquímicas y fenotípicas sencillas que permiten separar estas levaduras.
Es de destacar que la presencia de material purulento en la descarga, nos lleva en primera instancia, a indicar antibioticoterapia, como sucedió en el caso presentado, pero ante la ausencia de respuesta a dicha terapéutica, debemos pensar en la naturaleza micótica de la infección y seleccionar el antifúngico indicado13,14, 15.16
Fig 1 Gran descarga purulenta, clinicamente visible al despertar
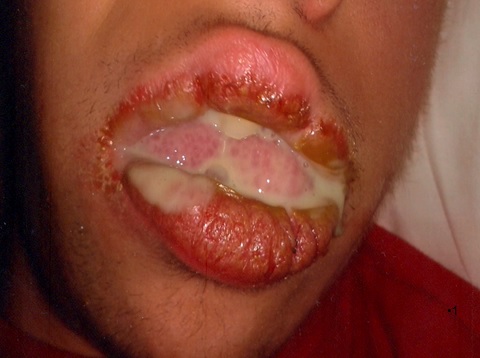
Fig 2 La mucosa del labio y la lengua muestra imàgenes papilomatosas compatibles con sindrome de Cowden.
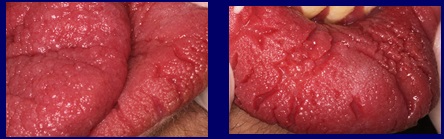
Fig3 Los pliegues papilomatosos y los surcos causados por la acción de la infección micótica crónica, constituyen el reservorio ideal para mantener activa la infección.
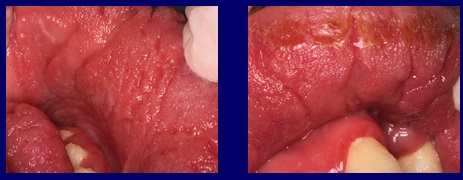
Fig4 Luego del tratamiento con voriconazol, 200 miligramos dos veces por dia por cuatro meses, desaparece la descarga purulenta oral y mejora la textura de la mucosa.
Autores: Ceccotti EL1, Turcot L2, Molgatini S2Gliosca L2, Fedelli L2, Bruzzone R.3
1 Academia Nacional de Odontologia
2 Cátedra de Microbiología y Parasitología de la Facultad de Odontología de la Universidad de Buenos Aires.
3 Ex Prof, Titular Clinica Estomatologica. USAL.AOA
1. Eversole LR, Sorenson HW. Oral florid papillomatosis in Down's syndrome. Oral Surg Oral Med Oral Pathol 1974 Feb;37(2):202-7.
2. De la Torre C, Cruces MJ. Cowden's disease and Down syndrome. An exceptional association. J Am Acad Dermatol 1991 Nov;25(5 Pt 2):909-11.
3. Bloemers BLP, Broers CJM, Bont L, Weijerman ME, Gemke RJBJ, van Furth AM. Aumento del riesgo de infecciones de las vías respiratorias en los niños con síndrome de Down: consecuencia de un sistema inmune alterado. Microbes and Infection (2010), doi:101016/j.micinf.2010.05.007
4. Yasui K, Shinozaki K, Nakazawa T, Agematsu K, Komiyama A. Presenility of granulocytes in Down syndrome individuals. Am J Med Genet 1999;84:406-12.
5. Kusters MAA, Verstegen RHJ, Gemen EFA, de Vries E. Intrinsic defect of the immune system in children with Down syndrome. Clin Exper Immunol 2009;156:189-936. 6. Wllis J,Iraola-Guzmán S, Saus E,Ksiezopolska E, Cozzuto L, Bejarano L, Andreu-Somavilla N, Alloza-Trabado M, Puig-Sola A, Blanco A, Broglio E, Carolis C, Hecht J , Ponomarenko Gabaldón J (2021) El microbioma oral en el síndrome de down y sus implicaciones en la salud bucal, Journal of Oral Microbiology13:1, DOI: 10.1080 / 20002297.2020.1865690
7. Kotaro Komatsu , Sayaka Yamaguchi , Ryo Yasumura 1, Kenzo Takahashi Absceso cutáneo por Candida dubliniensis: reporte de un caso J Dermatol. 2020 julio; 47 (7): e253-e254 doi: 10.1111 / 1346-8138.15373. Epub 2020 7 de mayo.
8. Ribeiro L, Scroferneker ML, Carvalhaes M, Campos E, Ferreira W, Cardoso Nagato G, de Sousa N, Dias S. Cepas gigantes de candida albicans y su potencial de expresión/ fenotípica en niños portadores del sindrome de down Home ediciones 2006;volumen 44 nº 1.
9. Quesada Gomez C, Murillo Hidalgo L, Ureña Varela M, Vargas Monge E. Candida dubliniensis.Revista médica de Costa Rica y Centroamérica lxiv 2007;(578):43-8.
10. Martinez M, López-Ribot JL, Kirkpatrick WR, Coco BJ. Bachmann SP, Patterson TF. Replacement of Candida albicans with C. dubliniensis in Human Inmunodeficiency Virus-Infected Patients with Oropharyngeal Candidiasis Treated with Fluconazole. Journal of Clinical Microbiology 2002;40:3135-9.
11.Jabra-Rizk MA, Falkler WA, Merz WC, Baqui AAM, Kelley JI, Meiller TF. Retrospective Identification and Characterization of Candida dubliniensis Isolates among Candida albicans Clinical Laboratory Isolates from Human Immunodeficiency Virus (HIV)-Infected and Non-Hl V- Infected Individuals. Journal of Clinical Microbiology 2000;38:2423-6.
12. García-González C, María Mehlis A, García-Rodríguez J. Prevalencia de Candida dubliniensis en un hospital terciario de Madrid Enferm Infecc Microbiol Clin 2011;29:159-60.
13. Maglione M, Angerame D, Costantinides F, Visintini E. Buccal-masseteric mycotic abscess as a consequence of dental procedures. Minerva Stomatol. 2006 Nov-Dec;55(11-12):647-54.
14. Fennelly AM, Slenker AK, Murphy LC, Moussouttas M, DeSimone JA. Candida cerebral abscesses:a case report and review of the literature. Med Mycol 2013 Oct;51(7):779-84. Epub 2013 May 8.
15. Enache-Angoulvant A, Torti F, Tassart M, Poirot JL, Jafari A, Roux P, Hennequin C. Candidal abscess of the parotid gland due to Candida glabrata: report of a case and literature review. Med Mycol 2010 Mar;48(2):402-5.
16. Even-Tov E, Niv A, Kraus M, Nash M. Candida parotitis with abscess formation. Acta Otolaryngol 2006 Mar;126(3):33.
Fuente: intramed.net